
33、[答案](1)HClO4(1分)
(2)Fe3++3H2O Fe(OH)3(胶体)+3H+( 2分) abd(3分)
Fe(OH)3(胶体)+3H+( 2分) abd(3分)
(3) ①90% (1分) ② S O2+2HClO3==H2SO4+2ClO2(3分)
[解析]遇苯酚呈紫色的为FeCl3,,所以Z为Fe,Y为Cl,则X为S
⑶X单质在空气中燃烧生成一种无色有刺激性气味的气体为SO2,,
①每1mol该气体被O2氧化放热98.0kJ。若2mol 该气体与1mol O2在此条件下发生反应,达到平衡时放出的热量是176.4kJ,则该气体的转化率为176.4÷98÷2×100%=90%,
②该酸的某盐常用于实验室制取氧气,则酸可能是HClO3或者HMnO4,,1.5molY的这种酸发生反应有1.5×6.02×1023个电子转移,则降低一个价态生成对应氧化物,则酸为HClO3
[知识点讲解]本题涉及常见物质性质、氧化还原反应、热化学反应等基础知识,在解题时应多加联系找出符合条件的物质从而一步步解答。
3 4.(7分)下表列出了前20号元素中的某些元素性质的有关数据:
4.(7分)下表列出了前20号元素中的某些元素性质的有关数据:
|
元素编号w.w.^w.k.&s.5* 元素性质 |
① w.w.^w.k.&s.5*u.c.#o |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
⑩ |
|
原子半径(10-10m) |
1.52 |
2.27 |
0.74 |
1.43 |
0.77 |
1.10 |
0.99 |
1.86 |
0.75 |
0.71 |
|
最高价态 |
+1 |
+1 |
-- |
+3 |
+4 |
+5 |
+7 |
+1 |
+5 |
-- |
|
最低价态 |
-- |
-- |
-2 |
-- |
-4 |
-3 |
-1 |
-- |
-3§ |
-1 |
试回答下列问题(注:所有非金属元素均有负价):
(1) 以上10种元素的原子中,最易失去电子的是 __(填写编号)。
(2) 上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是(写分子式)______________ _____,固态时形成
晶体
_____,固态时形成
晶体
(3)某元素R的原子半径为1.02×10-10m,该元素在周期表中位于___________ ___
(4)若物质Na2R3是一种含有非极性共价键的离子化合物,请写出该化合物的电子式_________________________,属于 晶体
3 4.[答案](1) ② (2) PCl3(或CCl4 ) 分子 (3)第三周期 第ⅥA族
4.[答案](1) ② (2) PCl3(或CCl4 ) 分子 (3)第三周期 第ⅥA族
(4) 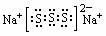 离子
离子
[解析]①②⑧都是+1,由半径大小可知①为Li②为K⑧Na
⑥⑨+5则⑥为P⑨为N⑦⑩为-1,根据半径则⑦为Cl⑩为F③即为O
[知识点讲解]通过表中数据比较相同价态原子,再结合半径大小来判断其元素种类,由此进行解题即可得出对应答案。
33、(10分)有X、Y、Z三种常见元素,已知:①X2-、Y-均与Y的气态氢化物分子具有相同的电子数;②Z与Y可组成化合物ZY3,ZY3溶液遇苯酚呈紫色。请回答:
⑴Y的最高价氧化物对应水化物的化学式是 。w.w.^w.k.&s.5*
⑵将ZY3溶液滴入沸水可得红褐色液体,
反应的离子方程式是 ,
此液体具有的性质是 (填写序号字母)。
a.光束通过该液体时形成光亮的“通路” w.w.^w.k.&s.5*
b.插入电极通直流电后,有一极附近液体颜色加深
c.向该液体中加入硝酸银溶液,无沉淀产生w.w.^w.k.&s.5*
d.将该液体加热、蒸干、灼烧后,有氧化物生成
⑶X单质在空气中燃烧生成一种无色有刺激性气味的气体。
①已知一定条件下,每1mol该气体被O2氧化放热98.0kJ。若2mol 该气体与1mol O2在此条件下发生反应,达到平衡时放出的热量是176.4kJ,则该气体的转化率为 。
②该无色有刺激性气味的气体与含1.5molY的一种含氧酸(该酸的某盐常用于实验室制取氧气)的溶液在一定条件下反应,可生成一种强酸和一种氧化物,若有1.5×6.02×1023个电子转移时,写出该反应的化学方程式,并用单线桥标出电子转移的方向和数目
。
32.[答案](1)
① Na3N的电子式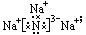 离子晶体 ②<
离子晶体 ②<
③Na3N+3H2O=NH3↑+3NaOH,极性,极性,分子
(2)A为原子晶体,B为离子晶体,C为分子晶体
[解析]非常基础,看答案即可知。
[知识点讲解]物质机构的基础应用,了解晶体特点进行分类。
32.(11分)(1)Na3N与水作用可发生水解反应,并产生气体,填空回答下列问题:
①写出Na3N的电子式:______________________ 属于 晶体。
②Na+与N3-的微粒半径关系是Na+__________N3-(填“>”、“=”、“<”)
③写出Na3N与水反应的化学方程式:_________________ ___,
产生的气体是含 键的 分子(填极性、非极性),固态时形成 晶体。
(2)有三种固态物质,它们的性质如下:
A物质:无色晶体,熔点3550℃,不导电,质硬,难溶于水及有机溶剂。
B物质:无色晶体,溶于水,质硬而脆,熔点800℃,熔化时 能导电。
能导电。
C物质:熔点-56.6℃,微溶于水,硬度小,固态或液态时不导电。
根据上述性质,可推断它们晶体类型为:A为_____晶体,B为_____晶体,C为____晶体。
31、[答案](1)D 、Na+
(2)2Al+2OH-+2H2O=2AlO2-+3H2↑
(3)CaF2
[解析]B、C、D同周期, B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水,由这个信息即可知C为Al,则B可能为Na或者Mg,而Mg最高价氧化物的水化物难溶,所以B为Na,由此E为Ca。D可能为P、S、Cl
由(3)可知A和E可组成离子化合物,同时晶胞如图,从中可以看出阴阳离子个数比为1:2,所以A为F,AD同主族,则D为Cl。
[知识点讲解]本题是物质结构的基础题,同时利用了元素周期表和晶体结构的知识来进行解题。
31、(5分)A、B、C、D、E都是元素周期表中前20号元素,原子序数依次增大,B、C、D同周期,A、D同主族,E和其它元素既不在同周期也不在同主族,B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水。根据以上信息回答下列问题:
(1)A和D氢化物中,沸点较低的是 (选填“A”或“D”);A和B的离子中,半径较小的是 (填离子符号)
(2)元素C的单质与B的最高价氧化物的水化物反应离子方程式为

 (3)A和E可组成离子化合物,其晶胞(晶胞是在
(3)A和E可组成离子化合物,其晶胞(晶胞是在
晶体中具有代表性的最小重复单元)结构如下图所
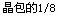
 示,阳离子(用“ ”表示)位于该正方体的顶点或
示,阳离子(用“ ”表示)位于该正方体的顶点或
 面心;阴离子(用“ ”表示)均位于小正方体中心。
面心;阴离子(用“ ”表示)均位于小正方体中心。
该化合物的化学式是 。
30、[答案]A
[解析]利用盖斯定律,两式相减从而得出A正确,B错误。
因为O2比O3能量低所以O2比O3稳定,O2变O3为吸热反应
[知识点讲解]盖斯定律:定压或定容条件下的任意化学反应,在不做其它功时,不论是一步完成的还是几步完成的,其热效应总是相同的(反应热的总值相等)。
Ⅱ卷(共50分)请将答案填写在答卷纸的相应位置上
30、已知25℃、101kPa条件下:4Al(s)+3O2(g)==2Al2O3(s);△H=-2834.9kJ·mol-1
4Al(s)+2O3(g)==2Al2O3(s);△H=-3119.1kJ·mol-1
由此得出的正确结论是( )w.w.^w.k.&s.5*
A.等质量的O2比O3能量低,由O2变O3为吸热反应
B.等质量的O2比O3能量低,由O2变O3为放热反应
C.O3比O2稳定,由O2变O3为吸热反应
D.O2比O3稳定,由O2变O3为放热反应
29. [答案]A
[解析]由晶胞可得一个晶胞中含CsCl为1个,相邻的两个的核间距为a cm,则晶胞的体积为a3cm3.。又知CsCl晶体的密度为,所以一个晶胞的质量为ρa3g,则CsCl的式量为NA个晶胞的质量即NAρa3
[知识点讲解]晶胞应用计算,对此要弄明白其中的数量关系。
29.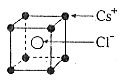 已知CsCl晶体的密度为,NA为阿伏加德罗常数,相邻的两个的核间距为a cm,如图所示,则CsCl的式量可以表示为 (
)
已知CsCl晶体的密度为,NA为阿伏加德罗常数,相邻的两个的核间距为a cm,如图所示,则CsCl的式量可以表示为 (
)
A. B.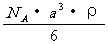
C. 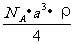 D.
D.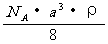
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com