
3.默写古诗文名句,并写出相应的作家、篇名。(10分)
①日月之行,若出其中; ▲ , ▲ 。(曹操《观沧海》)
②问君何能尔? ▲ 。(陶渊明《 ▲ 》)
③长风破浪会有时, ▲ 。( ▲ 《行路难》)
④八百里分麾下炙,五十弦翻塞外声。 ▲ 。(辛弃疾《破阵子》)
⑤枯藤老树昏鸦,小桥流水人家, ▲ 。(马致远《天净沙 秋思》)
⑥ ▲ , ▲ ;择其善者而从之,其不善者而改之。(《<论语>八则》)
⑦ ▲ , ▲ ,此先汉所以兴隆也……(诸葛亮《出师表》)
⑧至若春和景明, ▲ ,上下天光, ▲ ……(范仲淹《岳阳楼记》)
2.下面一段话中有四个错别字,把它们找出来填入表中,然后改正。(4分)
林子里弥漫着深沉的静寂和安详,苍松翠柏相印成趣。五彩斑澜的野花,遍地都是。林中鸟语,枝头蝉鸣,仿佛互相唱和,给人一种甜密的安泰与和平的感觉。汤姆繁躁的心情也安定下来了。
1.根据汉语拼音写出汉字。(4分)
①梦 ▲ (huàn) ②挺 ▲ (bá) ③新陈 ▲ (dài)谢 ④孜孜不 ▲ (juàn)
37.[答案](1)Fe2Al (2)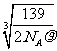 (各2分)
(各2分)
[解析](1)由晶胞可计算出Fe原子个数为8×1/8+6×1/2+12×1/4+1=8
Al原子个数为4,所以化学式为Fe2Al
(2)由(1)中的计算得晶胞中含4个Fe2Al,设两个Fe原子之间的距离为x,则(2x)3÷4=139/ΡNA,x=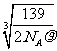
[知识点讲解]本题考查晶体结构的计算,对此计算应注重对晶胞结构的认识,端点每个晶胞占1/8,面上原子占1/2,边上原子占1/4.。
37.(4分) 晶体是质点(分子、离子或原子等)在空间有规则地排列、具有整齐外形、以多面体出现的固体物质。在空间里无限地周期性的重复能形成晶体的、具有代表性的最小单元,称为晶胞。一种Al-Fe合金的立体晶胞如下图所示。w.w.^w.k.&s.5*
|
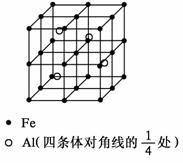
请据此回答下列问题:
(1) 确定该合金的化学式____________。
(2) 若晶体的密度为ρ g/cm3,NA为阿伏加德罗常数,则此合金中最近的两个Fe原子之间的距离(用含ρ的代数式表示,不必化简)为___________________cm。w.w.^w.k.&s.5*
w.w.^w.k.&s.5*
36、[答案](1)H2(g)+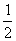 O2(g)=H2O(l);△H = - 286kJ /mo1(1分) (2)<(1分)
O2(g)=H2O(l);△H = - 286kJ /mo1(1分) (2)<(1分)
(3)283akJ<Q<890akJ(1分) (4) 284.5akJ<Q<586.5akJ(1分)
[解析](2)水蒸气比液态水能量高,所以小于
(4)若将amolCH4、CO和H2的混合气体完全燃烧,生成CO2气体和液态水,且CO2和水的物质的量相等,按照化学方程式CH4+2O2=CO2+2H2O,2CO+O2=2CO2,2H2+O2=2H2O用极限法由化学方程式知混合物的组合只能是CH4、CO和H2、O2。
则如果是CH4、CO时,二者比例必然为1:1,Q=1/2×(890+283)a=586.5akJ
如果是H2、O2比例也为1:1,Q=1/2×(286+283)a=284.5akJ
[知识点讲解]本题考查学生对热化学知识的掌握,同时考查了学生的计算能力。对此应该在训练学生热化学的基础知识同时加强学生计算方法的应用。
35.[答案](1)烧杯、量筒、环形玻璃搅拌棒、温度计 (每个1分)
(2)保证盐酸完全被中和(1分)
(3)偏低(1分) (4)△H= - 56 kJ/mol (1分,有错不得分)
(5)偏低,(1分) 因为醋酸电离要吸收热量,造成测得的中和热数值偏低。(1分)
(必须答出:醋酸电离要吸收热量,才能得1分)
[解析](1)烧杯、量筒、环形玻璃搅拌棒、温度计
(2)保证盐酸完全被中和
(3)偏低
(4)△H=-0.418×6.7÷0.05kJ/mol=-56.01kJ/mol
(5)偏低, 因为醋酸电离要吸收热量,造成测得的中和热数值偏低。
[知识点讲解]本题考查中和热的测定,同时联系了反应热的计算,综合型的基础题,注重基础考查。
w.w.^w.k.&s.5*36、(4分)已知1molCO气体完全 燃烧生成CO2气体放出283kJ的热量,1molH2气体完全燃烧生成液态水放出286kJ的热量,1molCH4气体完全燃烧生成CO2气体和液态水放出890kJ的热量
燃烧生成CO2气体放出283kJ的热量,1molH2气体完全燃烧生成液态水放出286kJ的热量,1molCH4气体完全燃烧生成CO2气体和液态水放出890kJ的热量
(1)写出H2完全燃烧的热化学方程式
。(2)若1molCH4气体完全燃烧生成CO2气体和水蒸 气放出的热量 890kJ
气放出的热量 890kJ
(填>、<或=)
(3)若将amolCH4、CO和H2的混合气体完全燃烧,生成CO2气体和液态水,放出热量(Q)的取值范围是 。
(4)若将amolCH4、CO和H2的混合气体完全燃烧,生成CO2气体和液态水,且CO2和水的物质的量相等时,放出热量(Q)的取值范围是 。
35.(9分)某实验小组设计用50 mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液进行中和反应,测定中和热,中和热测定实验的关键是要比较准确地配制一定物质的量浓度的溶液,量热器要尽量做到绝热;在量热的过程中要尽量避免热量的散失,比较准确地测量出反应前后溶液温度的变化。回答下列问题:
(1)中和热的测定所需的玻璃仪器有
(2)本实验中用稍过量的NaOH的原因是 。
(3)在反应中若因为有放热现象,而造成少量HCl挥发,则测得的中和热数值 (填偏高、偏低或不变);
(4)该实验小组做了三次实验,每次取溶液各50mL,并记录如下原始数据。
|
实验序号 w. |
起始温度t1/℃ w.w.^w.k.&s.5* |
终止温度(t2)℃[来 |
温差(t2-t1)℃ |
||
|
盐酸 |
NaOH溶液 |
平均值 |
|||
|
1 |
25.1 |
24.9 |
25.0 |
31.6 w.w.^w.k.&s.5* |
6.6 |
|
2 |
25.1 |
25.1 |
25.1 |
31.8 w.w.^w.k.&s.5* |
6.7 |
|
3 |
25.1 |
25.1 |
25.1 w.w.^w.k.&s.5* |
31.9 w.w.^w.k.&s.5* |
6.8 |
已知盐酸、NaOH溶液密度近似为1.00g/cm3,中和后混和液的比热容 C=4.18J/(g·℃)则该反应的中和热为△H=_______________________________;
(5)若用等浓度的醋酸代替盐酸与NaOH溶液反应,则测得的中和热的数值会 (填偏高、偏低或不变),其原因
 ;
;
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com