
16.(11分)(创新探究)如图所示,“二氧化碳是否在有水存在时,才能与过氧化钠反应?”这个问题可通过以下实验加以证明。
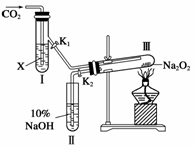
(1)按图装置,在干燥的试管Ⅲ中装入Na2O2后,在通入CO2之前,应事先将活塞(K1、K2)关闭好,目的何在?
________________________________________________________________________
________________________________________________________________________。
(2)试管Ⅰ内的试剂X是____________时,打开活塞K1、K2,加热试管Ⅲ约5分钟后,将带火星的小木条插入试管Ⅱ的液面上,可观察到带火星的小木条不能剧烈地燃烧起来,且Ⅲ内淡黄色粉末未发生变化。则所得的化学结论是
________________________________________________________________________。
(3)试管Ⅰ内试剂为CO2饱和水溶液时,其它操作同(2),通过
____________________________________________________________________
________________________的现象,可以证明Na2O2与潮湿的CO2能反应且放出O2。
(4)CO2与过氧化钠反应机理也可用示踪原子分析加以证明,请完成下列反应方程式:
__Na2O2+__C18O2+__HO―→
________________________________________________________________________。
解析 本题旨在利用对比实验,探究Na2O2与CO2反应的环境,故实验步骤中,首先让Na2O2与干燥CO2反应,必须保证整个环境中不能有H2O,故通入反应装置前CO2必须干燥。
答案 (1)以防止试管Ⅲ内的过氧化钠和外界相通时发生吸潮现象
(2)浓H2SO4 过氧化钠与干燥的CO2不反应
(3)带火星的小木条在试管Ⅱ的液面上剧烈燃烧,同时,Ⅲ内固体由淡黄色变为白色
(4)2Na2O2+2C18O2+2HO===2Na2C18O3+O2↑+2H2O
15.(9分)(2009·咸阳调研)在隔绝空气的条件下,某同学将一块部分被氧化的钠块用一张已除去氧化膜、并用针刺一些小孔的加NaOH溶液箔包好,然后放入盛满水且倒置于水槽中的容器内。待钠块反应完全后,在容器中仅收集到1.12 L氢气(标准状况),此时测得加NaOH溶液箔质量比反应前减少了0.27 g,水槽和容器内溶液的总体积为2.0 L,溶液中NaOH的浓度为0.050 mol·L-1(忽略溶液中离子的水解和溶解的氢气的量)。
(1)写出该实验中发生反应的化学方程式。
(2)试通过计算确定该钠块中钠元素的质量分数。
解析 (1)①2Na+2H2O===2NaOH+H2↑
②Na2O+H2O===2NaOH
③2Al+2NaOH+2H2O===2NaAlO2+3H2↑
(2)n(Al)==0.010 mol
根据反应③可得由加NaOH溶液消耗NaOH的物质的量为n(NaOH)=0.010 mol
生成的氢气的物质的量为n(H2)=0.015 mol
那么由金属钠生成的氢气的物质的量为
n(H2)=-0.015 mol=0.035 mol
根据反应①可得金属钠的物质的量为n(Na)=2×0.035 mol=0.070 mol
又因为反应后溶液中的NaOH的物质的量为
n(NaOH)=2.0 L×0.050 mol·L-1=0.10 mol
所以溶液中Na+的总物质的量即原金属钠的总物质的量为
n(Na+)=0.10 mol+0.010 mol=0.11 mol
n(Na2O)==0.020 mol
该钠块中钠元素的质量分数为:
×100%≈89%
答案 (1)①2Na+2H2O===2NaOH+H2↑
②Na2O+H2O===2NaOH
③2Al+2NaOH+2H2O===2NaAlO2+3H2↑
(2)89%
14.(8分)(2010·大连质检)如图中A到F是化合物,且A、B、E、F均含钠元素,G是单质。
A(固体)加热①B + C + D
,+E ,+E
B+G F+G
 A(溶液)+F(溶液+C+D③ B(溶液)
A(溶液)+F(溶液+C+D③ B(溶液)
(1)写出A、B、E、F的化学式:
A________,B________,E________,F________。
(2)写出反应①②③的化学方程式:
①________________________________________________________________________;
②________________________________________________________________________;
③________________________________________________________________________。
答案 (1)NaHCO3 Na2CO3 Na2O2 NaOH
(2)①2NaHCO3Na2CO3+H2O+CO2↑
②NaHCO3+NaOH===Na2CO3+H2O
③Na2CO3+H2O+CO2===2NaHCO3
13.(12分)(2009·宁夏理综,27)下图表示有关物质(均由短周期元素形成)之间的转化关系,其中A为常见的金属单质,B为非金属单质(一般是黑色粉末),C是常见的无色无味液体,D是淡黄色的固体化合物。(反应条件图中已省略)
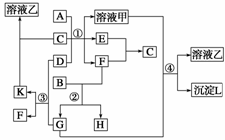
(1)A、B、C、D代表的物质分别为
___________________、 、 、 (填化学式);
(2)反应①中的C、D均过量,该反应的化学方程式是
________________________________________________________________________;
(3)反应②中,若B与F的物质的量之比为4∶3,G、H分别是 、 (填 化学式);
(4)反应③中产物K的化学式为 ;
(5)反应④的离子方程式为
________________________________________________________________________
________________________________________________________________________。
解析 框图中的所有物质均由短周期元素组成。B为非金属单质(一般是黑色粉末)可判断B可能为碳元素;C为常见的无色无味液体,则C可能是H2O;D是淡黄色的固体化合物,则D为Na2O2;反应①中Na2O2与H2O反应生成NaOH和O2。常见金属A与NaOH溶液能反应,则A为Al。根据反应①可判断E、F一种是H2另一种是O2,根据反应③,C不与H2反应,可与O2反应,可判断E是H2,F是O2;当n(C)∶n(O2)=4∶3反应时,生成物为CO2与CO的混合气体,CO2与Na2O2、NaAlO2反应,CO与Na2O2、NaAlO2不反应,可判断G是CO2,H为CO。因为反应①中的H2O、Na2O2均过量,所以溶液甲是NaOH与NaAlO2的混合溶液。
答案 (1)Al C H2O Na2O2
(2)4Al+2Na2O2+6H2O===4NaAlO2+O2↑+6H2↑
(3)CO2 CO (4)Na2CO3
(5)CO2+AlO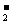 +OH-+H2O===CO
+OH-+H2O===CO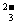 +Al(OH)3↓
+Al(OH)3↓
26、(8分)A、B、C等八种物质有如下框图所示转化关系。又知,A是由地壳中含量最多的金属元素形成的单质,C、D、E是常见的由短周期元素形成的气体单质,气体F与气体G相遇产生大量的白烟,H是厨房中必备一种调味盐(部分反应物和生成物及溶剂水已略去)。
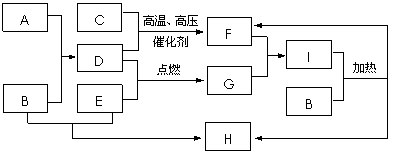
请回答下列问题:
⑴ B的化学式是 ,F的化学式是 。
⑵写出D和E反应的化学方程式: 。

⑶ 如何检验I中的阳离子
27(3分)如图:以一铜锌合金为阳极,一纯铜为阴极(起始时两电极质量相等),

进行电解,电解液为硫酸铜溶液,当外电路有1.806×1023个电子转移时,
阴极比阳极重19. 25g ,求铜锌合金中铜的质量分数。
(已知:电极反应式为 阳极: Zn-2e-=Zn2+、Cu-2e-=Cu2+
阴极:Cu2+ +2e-=Cu )
2009-2010学年度第二学期期末考试
25. (4分)甲、乙、丙、丁分别是乙烷、乙烯、乙炔、苯中的一种;
①甲、乙能使溴水褪色。乙与等物质的量的H2反应生成甲,甲与等物质的量的H2反应生成丙。
②丙既不能使Br2的CCl4溶液褪色,也不能使KMnO4酸性溶液褪色。
③丁既不能使Br2的CCl4溶液褪色,也不能使KMnO4酸性溶液褪色,但在一定条件下可与溴发生取代反应。1mol丁可以和3molH2完全加成。
据以上叙述完成下列填充:
甲的结构式____________________ ; 乙的电子式______________________;
丙的结构简式_________________________。
丁与溴发生取代反应的方程式_____________________________________________。
24.(16分)下表是元素周期表的前三周期:
|
|
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
|
一 |
A |
|
|
|
|
|
|
|
|
二 |
B |
|
|
C |
D |
E |
F |
|
|
三 |
G |
|
H |
|
|
|
I |
J |
回答下列问题:
⑴写出下列元素的元素的符号:
F______________、J_____________。
⑵G元素与E元素形成的化合物的化学式是____________、____________,它们都是_________________(填“离子”或“共价”)化合物。
⑶表格中十种元素的最高氧化物对应的水化物中,酸性最强的是_____________,属于两性氢氧化物的是_______________(用化合物的化学式表示)。
⑷只含有A、C两种元素的化合物称为_____________,这些化合物中:
①相对分子质量最小的是________________,该化合物的分子空间构型是_______________;
②分子中含有双键,但原子数最少的是______________,它与HCl反应的化学方程式为______________________________;
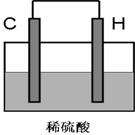
⑸将H单质与C的一种单质(导体)按如下图装置连接,该装置称为_____________。其中C极为______________,(填正负极)并写出该电极反应式为:____________________。请在下图中标出电子流动方向。

23、用下列实验装置完成对应的实验(部分仪器巳省略),能达到实验目的的是
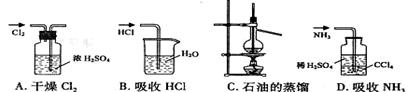
选择题答案
22、下列各组物质中,互为同系物的是
A.126C和126C B.正丁烷和异丁烷 C.CH4和C3H8 D.金刚石和石墨
21.下列各项中表达正确的是
A.F原子结构示意图: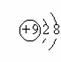 B.次氯酸电子式
B.次氯酸电子式
C.H、D、T表示同一种核素 D.CH4分子的球棍模型: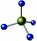
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com