
27、(16分)SO2、H2O2、氯水均有漂白的能力,在BaCl2与品红的混合液中通入过量SO2,观察到的现象是红色 (填“褪去”或“不褪”), (填“有”或“无”)沉淀生成;若继续通入过量氯气,观察到的现象是溶液显 (填“红色”或“无色”此处不考虑氯气溶于水所显的颜色),溶液中 (填“有”或“无”)沉淀析出。若在BaCl2与品红的混合液中先通入0.5L Cl2(标准状况下),发现红色褪尽,再通入0.5L SO2(标准状况下),则观察到的现象是 (填以下番号)
A溶液一定恢复红色 B溶液可能恢复红色 C溶液不可能恢复红色
D溶液中一定会析出沉淀 E溶液中可能会析出沉淀 F溶液中不可能析出沉淀
若在1.0L0.1mol·L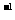 的双氧水中先通入2.24L(标准状况)C12,完全反应后再通入2.24L(标准状况)SO2,最后向所得溶液中滴入少量BaCl2与品红的混合液,则观察到的现象是 (填以下番号)
的双氧水中先通入2.24L(标准状况)C12,完全反应后再通入2.24L(标准状况)SO2,最后向所得溶液中滴入少量BaCl2与品红的混合液,则观察到的现象是 (填以下番号)
A品红可能褪色 B品红不可能褪色 C溶液中一定会析出沉淀
D溶液中可能会析出沉淀 E溶液中不可能析出沉淀
若在1.0L0.1mol·L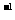 的双氧水中先通入2.24L(标准状况)SO2,再滴入2滴紫色石蕊,则溶液显 (填“红”“紫”“蓝”“无”)色,原因是
。(用离子反应方程式解释)
的双氧水中先通入2.24L(标准状况)SO2,再滴入2滴紫色石蕊,则溶液显 (填“红”“紫”“蓝”“无”)色,原因是
。(用离子反应方程式解释)
26、(8分)用地壳中某主要元素生产的多种产品在现代高科技中占重要位置,足见化学对现代物质文明的重要作用。例如:
(1)计算机的芯片的主要成分是 ;(填名称)
(2)光导纤维的主要成分是 ;(填化学式)
(3)地壳中含量第一的元素与铝元素组成的化合物A可溶于氢氧化钠溶液,写出此反应的化学反应方程式 。
(4)铝硅酸盐可加工制成吸附剂、干燥剂、催化剂,试将Al2(SiO3)3改写成氧化物的形式 。
25、元素X、Y、Z原子序数之和为36,X+与Z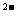 具有相同的核外电子层结构。下列推测不正确的是
具有相同的核外电子层结构。下列推测不正确的是
A.同周期元素中X的金属性最强
B.原子半径X>Y,离子半径X+ < Z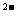
C.由X、Y、Z三种元素组成的化合物可能有强还原性
D.同族元素中Z的氢化物稳定性最高
第Ⅱ卷(非选择题 共67分)
24、CuSO4在一定条件下发生分解反应,产物为CuO、SO2、SO3、O2,则氧化产物与还原产物的物质的量之比为:
A.1:2 B.2:1 C.1:1 D.3:1
23、X、Y、Z、M是元素周期表中前20号元素,其原子序数依次增大,且X、Y、Z相邻。X的核电荷数是Y是核外电子数的一半,Y与M可形成化合物M2Y。下列说法正确的是
A.还原性:X的氢化物>Y的氢化物>Z的氢化物
B.简单离子的半径:M的离子>Y的离子>Z的离子>X的离子
C.Z元素的最高价氧化物对应水化物的化学式为HZO4
D.YX2、M2Y中都含有极性共价键
22、意大利科学家合成了一种新型氧分子,它由4个氧原子构成的O4分子,专家认为它液化后的能量密度比普通氧分子高得多。下列关于该分子的叙述正确的是
A.O2和O4互称同位素
B.O4分子的摩尔质量为64g
C.等物质的量的O4和O2分子含有相同数目的氧原子
D.O4分子比O2分子氧化性更强
21、酸根离子RO3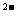 所含电子数比碳酸根离子CO3
所含电子数比碳酸根离子CO3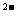 的电子数多10,则下列说法正确的是
的电子数多10,则下列说法正确的是
①R原子的电子层数比C原子的电子层数多1
②RO3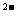 中R元素与CO3
中R元素与CO3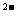 中C元素的化合价相同
中C元素的化合价相同
③RO3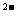 和CO3
和CO3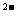 都只可能被还原,不可能被氧化
都只可能被还原,不可能被氧化
④R和C不是同周期元素,但都属于主族元素
⑤RO3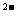 和CO3
和CO3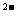 都能在溶液中与RO2反应
都能在溶液中与RO2反应
A.②③④⑤ B.①②④⑤ C.①②③⑤ D.①②③④
20、取100mL 18.3mol/L的H2SO4与Zn反应,当Zn完全溶解时,生成气体在标况下占有的体积为22.4L,将所得的溶液稀释成1L,测得溶液的H+浓度为1mol/L,则所生成的气体中SO2与H2的体积比约为
A.1:2 B.2:1 C.1:4 D.4:1
19、已知自然界中铱有两种质量数分别为191和193的同位素,而铱的平均相对原子质量为192.22,这两种同位素的原子个数比应为
A.39:61 B.61:39 C.1:1 D.39:11
18、下列叙述正确的是
A.SO2具有还原性,故可作漂白剂
B.Na的金属活动性比Mg强,故可用Na与MgCl2溶液反应制Mg
C.浓硫酸常温下可与铁反应生成SO2
D.将CO2通入Na2SiO3溶液可生成白色沉淀,通入过量CO2后沉淀消失
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com