
33.(2010广东理综卷)(16分)
某科研小组用MnO2和浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对其尾气进行吸收处理。
(1)请完成SO2与过量NaOH溶液反应的化学方程式:SO2+2NaOH = ________________.
(2)反应Cl2+Na2SO3+2 NaOH===2NaCl+Na2SO4+H2O中的还原剂为________________.
(3)吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl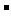 、OH
、OH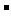 和SO
和SO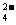 .请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气的CO2的影响).
.请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气的CO2的影响).
① 提出合理假设 .
假设1:只存在SO32-;假设2:既不存在SO32-也不存在ClO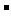 ;假设3:_____________.
;假设3:_____________.
② 设计实验方案,进行实验。请在答题卡上写出实验步骤以及预期现象和结论。限选实验试剂:3moL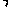 L-1H2SO4、1moL
L-1H2SO4、1moL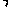 L-1NaOH、0.01mol
L-1NaOH、0.01mol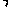 L-1KMnO4、淀粉-KI溶液、紫色石蕊试液.
L-1KMnO4、淀粉-KI溶液、紫色石蕊试液.
|
实验步骤 |
预期现象和结论 |
步骤1:取少量吸收液于试管中,滴加3 moL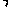 L-1
H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中. L-1
H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中. |
 |
|
步骤2: |
|
|
步骤3: |
|
解析:(1) NaOH过量,故生成的是正盐:SO2+2NaOH =Na2SO3+H2O。
(2)S元素的价态从+4→+6,失去电子做表现还原性,故还原剂为Na2SO3。
(3)①很明显,假设3两种离子都存在。
②加入硫酸的试管,若存在SO32-、ClO-,分别生成了H2SO3和HClO;在A试管中滴加紫色石蕊试液,若先变红后退色,证明有ClO-,否则无;在B试管中滴加0.01mol L-1KMnO4溶液,若紫红色退去,证明有SO32-,否则无。
L-1KMnO4溶液,若紫红色退去,证明有SO32-,否则无。
答案:
(1) Na2SO3+H2O
(2) Na2SO3
(3) ①SO32-、ClO-都存在
②
|
实验步骤 |
预期现象和结论 |
步骤1:取少量吸收液于试管中,滴加3 moL L-1
H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中 L-1
H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中 |
 |
|
步骤2:在A试管中滴加紫色石蕊试液 |
若先变红后退色,证明有ClO-,否则无 |
步骤3:在B试管中滴加0.01mol L-1KMnO4溶液 L-1KMnO4溶液 |
若紫红色退去,证明有SO32-,否则无 |
9.(2010天津卷)(18分)纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。
制备纳米TiO2的方法之一是TiCl4水解生成TiO2·x H2O,经过滤、水洗除去其中的Cl,再烘干、焙烧除去水分得到粉体TiO2 。
用现代分析仪器测定TiO2粒子的大小。用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+ ,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。
请回答下列问题:
⑴ TiCl4水解生成TiO2·x H2O的化学方程式为_______________________________。
⑵ 检验TiO2·x H2O中Cl-是否被除净的方法是______________________________。
⑶ 下列可用于测定TiO2粒子大小的方法是_____________________(填字母代号)。
a.核磁共振法 b.红外光谱法 c.质谱法 d.透射电子显微镜法
⑷ 配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的原因是_________________;使用的仪器除天平、药匙、玻璃棒、烧杯、量简外,还需要下图中的_____(填字母代号)。
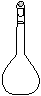



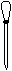

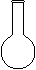

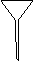

a b c d e
⑸ 滴定终点的现象是___________________________________________________。
⑹ 滴定分析时,称取TiO2(摩尔质量为M g·mol-1)试样w g,消耗c mol·L-1 NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数表达式为_________________________。
⑺ 判断下列操作对TiO2质量分数测定结果的影响(填“偏高”、“偏低”或“无影响”)
① 若在配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出,使测定结果_________________________。
② 若在滴定终点读取滴定管刻度时,俯视标准液液面,使测定结果_________。
解析:(1)设TiCl4的系数为1,根据元素守恒,TiO2·xH2O的系数为1,HCl的系数为4;再根据O元素守恒,可知H2O的系数为(2+x)。
(2)检验沉淀是否洗净的方法是,取少量洗涤液,检验溶液中溶解的离子是否还存在。
(3)核磁共振谱用于测有机物中含有多少种氢原子;红外光谱分析有机物含有何种化学键和官能团;质谱法常用于测有机物相对分子质量;透射电子显微镜可以观察到微粒的大小。
(4)NH4Fe(SO4)2易水解,故需加入一定量的稀硫酸抑制水解;配制一定物质的量浓度的溶液,还需要容量瓶和胶头滴管。
(5)因为是用KSCN作指示剂,终点时NH4Fe(SO4)2不再反应,生成血红色的Fe(SCN)3。
(6)根据得失电子守恒,有:1Ti3+-1Fe3+,故n(Fe3+)= n(Ti3+)= n(TiO2)=cV×10-3mol,其质量分数为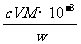 。
。
(7) NH4Fe(SO4)2溶液溅出,其物质的量浓度减小,消耗的体积增大,百分含量偏大;若终点俯视滴定管,读取的体积比实际消耗的体积偏小,质量分数偏小。
答案:
(1) TiCl4+(2+x) H2O TiO2·xH2O+4HCl
TiO2·xH2O+4HCl
(2)取少量水洗液,滴加AgNO3溶液,不产生白色沉淀,说明Cl-已除净。
(3)d
(4)抑制 NH4Fe(SO4)2水解 a c
(5)溶液变成红色
(6)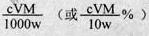
(7)偏高 偏低
命题立意:本题是围绕化学实验设计的综合性试题,主要考点有:化学方程式配平、沉淀的洗涤、颗粒大小的测量方法,和溶液的配制、滴定操作及误差分析,质量分数的计算等。
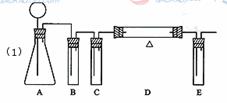
29.(2010全国卷1)(15分)请设计CO2在高温下与木炭反应生成CO的实验。
(1)在下面方框中,A表示有长颈漏斗和锥形瓶组成的气体发生器,请在答题卡上的A后完成该反应的实验装置示意图(夹持装置,连接胶管及尾气处理不分不必画出,需要加热的仪器下方用△标出),按气流方向在每件仪器下方标出字母B、C……;其他可选用的仪器(数量不限)简易表示如下:
(2)根据方框中的装置图,在答题卡上填写该表
|
仪器符号 |
仪器中所加物质 |
作用 |
|
A |
石灰石、稀盐酸 |
石灰石与盐酸生成CO2 |
|
|
|
|
(3)有人对气体发生器作如下改进:在锥形瓶中放入一小试管,将长颈漏斗下端插入小试管中。改进后的优点是 ;
(4)验证CO的方法是 。
[解析](1)这里与一般的物质制备思路是一致的,思路是先制备CO2,再净化除杂,干燥,接着再与C在高温下反应制CO,再除去未反应完的CO2,我们这里只需要画装置简图即可,这是自1998年高考科研测试首次出现,至今高考终于再现了!(见答案)
(2)与2009年27题相似这在今年的训练题中比较流行,如湖北省部分重点中学联考,黄冈中学模拟题等均再现了,不难学生能够作答和得分(见答案)
(3)这在以前题目中出现了多次,一般学生能答对
(4)此问答案很多可以点燃,看火焰看产物;也可以E后面再接个灼热CuO的玻璃管后面再接个放澄清石灰水的洗气瓶,看玻璃管和石灰水的现象;也可应直接用PdCl2溶液等
[答案]

(3) 可以通过控制加酸的量,来控制气体产生的快慢;同时小试管中充满盐酸,可以起到液封的作用,防止反应剧烈时气体经漏斗冲出
(4) 点燃气体,火焰呈蓝色,再用一个内壁附着有澄清石灰水的烧杯罩在火焰上,烧杯内壁的石灰水变浑浊
[命题意图]实验综合能力考查,主要考查实验方案的设计,仪器的组装,装置图的绘制,试剂的合理选择,装置的改进及评价,物质的的检验等
[点评]前面已经说过本题与2009年的27题思路一致,不过能力要求更高,学生最不会就是这种设计型的实验,去年的是个雏形,改革不彻底,实验原理早在前些年高考里面考过两次,并且学生都能动笔!今年提供的题目原理并不复杂,思路显然不唯一,因而提供的参考答案并不完美,例如(1)E后面再连接其他算不算错?(2)E中吸收CO2用澄清石灰石似乎不合理(考过多遍,浓度低,效果差,应用NaOH之类强碱),考生用用其他得不得分?(4)检验CO超纲,且答案不唯一,学生用其他合理答案能否得分?这些都是大家所关注的,希望能够引起命题人的注意,不要人为的制造不公平,一些优秀考生反而不能得分!
28.(2010全国卷1)(15分)有A、B、C、D、E和F六瓶无色溶液,他们都是中学化学中常用的无机试剂。纯E为无色油状液体;B、C、D和F是盐溶液,且他们的阴离子均不同。现进行如下实验:
①A有刺激性气味,用沾有浓盐酸的玻璃棒接近A时产生白色烟雾;
②将A分别加入其它五中溶液中,只有D、F中有沉淀产生;继续加入过量A时,D中沉淀无变化,F中沉淀完全溶解;
③将B分别加入C、D、E、F中,C、D、F中产生沉淀,E中有无色、无味气体逸出;
④将C分别加入D、E、F中,均有沉淀生成,再加入稀HNO3,沉淀均不溶。
根据上述实验信息,请回答下列问题:
(1) 能确定溶液是(写出溶液标号与相应溶质的化学式):
(2) 不能确定的溶液,写出其标号、溶质可能的化学式及进一步鉴别的方法:
[解析](I)由题干表述可知A和E不是盐,又由纯E为无色油状液体,推知E为硫酸(③步操作进一步确定);(II)由题干和①步操作可知A为氨水; (III)再由②步操作可知F中阳离子为Ag+发生的反应为:Ag++NH3·H2O=AgOH↓+NH4+;AgOH+2NH3·H2O=[Ag(NH3)2]++OH-+2H2O;而常见的盐中只有AgNO3可溶于水,故F为AgNO3;(IV)由③步操作可知B中阴离子应为CO32-,由于此无色无味的气体只能是CO2, B、C、D中能生成沉淀说明不能是HCO3-,而阳离子可是常见的K+、Na+、NH4+等待定(V)同样由②步操作D中能与氨水生成沉淀的无色溶液中常见的为阳离子为Mg2+或Al3+,而阴离子需待下步反应再确定;(VI)由④步操作生成的沉淀为可能为AgCl、AgBr、AgI、BaSO4、H2SiO3(不合理)等,但限于题干所述中学常用试剂,则沉淀应为AgCl和BaSO4,才不溶于HNO3,一个是与AgNO3结合生成的沉淀,一个是与硫酸结合形成的沉淀,故C应该同时含有Ba2+和Cl-即,C为BaCl2,进而推出D中阴离子应该为SO42-,因为题干所述盐溶液中阴离子均不同,故D为Al2(SO4)3或MgSO4其他解析见答案
[答案](1)A NH3·H2O或NH3 ;E H2SO4 F AgNO3 C BaCl2
若C作为不能确定的溶液,进一步鉴别的方法合理,同样给分
(2)B Na2CO3或K2CO3 用洁净的铂丝蘸取少量B,在酒精灯火焰中灼烧,若焰色呈黄色则B为Na2CO3溶液;若透过蓝色钴玻璃观察焰色呈紫色,则B为K2CO3溶液
D Al2(SO4)3或MgSO4 取少量D,向其中滴加NaOH溶液有沉淀生成,继续滴加过量的NaOH溶液,若沉淀溶解,则D为Al2(SO4)3溶液,若沉淀不溶解,则D为MgSO4溶液
[命题意图]考查学生的分析与综合能力,涉及到无机元素及其化合物的性质,离子反应,未知物的推断,物质的检验,常见物质量多与量少的反应不同,现象不同等,此题综合性强,难度大,区分度很好,是一道不可多得的经典好题!
[点评]此题一改过去每年元素推断的通病,思维容量显著增大能力要求高,与2008年全国卷I理综28题有得一拼,比2009年的第29题出得高超一些,相比以前的无机推断显然有质的飞跃,看到命题人在进步!但是此题是不是一点瑕疵没有呢?x显然不是,例如本题条件很宽广,没太明显的限制条件,因而答案是丰富多彩的,这不会给阅卷者带来喜出望外,只会增加难度,不好统一评分标准,也就缺乏公平性!特别是B和C上就有争议,如B还可能是(NH4)2CO3,C还可能是BaBr2、BaI2等,当然限制一下沉淀颜色就排除了C的歧义!
13.(2010浙江卷) 某钠盐溶液中可能含有 等阴离子。某同学取5份此溶液样品,分别进行了如下实验:
等阴离子。某同学取5份此溶液样品,分别进行了如下实验:
①用pH计测得溶液pH大于7
②加入盐酸,产生有色刺激性气体
③加入硝酸酸化的AgNO3溶液产生白色沉淀,且放出有色刺激性气体
④加足量BaCl2溶液,产生白色沉淀,该沉淀溶于稀硝酸且放出气体,将气体通入品红溶液,溶液不褪色。
⑤加足量BaCl2溶液,产生白色沉淀,在滤液中加入酸化的(NH4)2Fe(SO4)溶液,再滴加KSCN溶液,显红色
该同学最终确定在上述六种离子中公含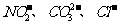 三种阴离子。
三种阴离子。
请分析,该同学只需要完成上述哪几个实验,即可得出此结论。
A. ①②④⑤ B. ③④ C. ③④⑤ D. ②③⑤
试题解析:
本题是离子组合推断、离子鉴别实验综合题。题型难点是:熟悉各种离子的标准检验方法,明确各种离子检验时的干扰因素。本题的难点还有:采用的出题方式和平时不同。
根据最终的离子分析:NO2-,存在时一定没有SO32-,I-。因NO2-,的氧化性可以使他们氧化。Cl-存在下的NO2-的检验:加入硝酸酸化的AgNO3溶液产生白色沉淀,且放出有色刺激性气体。即证明了NO2-的存在又检验出Cl-的存在。但,仅加入盐酸产生刺激性气体也可能有SO32-的存在。故须先确认SO32-不存在。SO32-,CO32-,SO42-的组合检验可以用:加足量BaCl2溶液,产生白色沉淀,该沉淀溶于稀硝酸且放出气体,将气体通入品红溶液,溶液不褪色。来确认SO32-, SO42-不存在,CO32-一定存在。故选择③④就可以,顺序是先④后③。
本题答案:B
教与学提示:
本题学生存在的困难是NO2-的检验,因为此内容在选修的《实验化学》中,可能会有所忽视。第二个难点是离子要分成两组分别进行检验。教学中碰到有一些学生:只要碰到离子组合检验与推断的题目就死机的现象。分析原因:各种典型离子的检验方式不是很熟练,没有对各种离子单独检验时的干扰因素,干扰离子进行排除。不重视各种相近实验现象进行区别对待,深入研究相近条件下的不同。教学中从单一离子检验开始,增加干扰,增加组合,增加性质区别等逐步复杂化。要多想为什么,多想如何干扰和排除干扰。
10.(2010江苏卷)下列实验操作与预期实验目的或所得实验结论一致的是
|
选项 |
实验操作 |
实验目的或结论 |
|
A |
某钾盐溶于盐酸,产生能使澄清石灰水变浑浊的无色无味气体 |
说明该钾盐是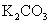 |
|
B |
向含有少量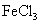 的 的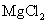 溶液中加入足量 溶液中加入足量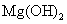 粉末,搅拌一段时间后过滤 粉末,搅拌一段时间后过滤 |
除去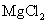 溶液中少量 溶液中少量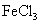 |
|
C |
常温下,向饱和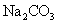 溶液中加少量 溶液中加少量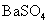 粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生 粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生 |
说明常温下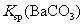 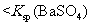 |
|
D |
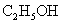 与浓硫酸170℃共热,制得的气体通人酸性 与浓硫酸170℃共热,制得的气体通人酸性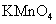 溶液 溶液 |
检验制得气体是否为乙烯 |
[答案]B
[解析]本题主要考查的是实验基本操作。A项,与盐酸反应产生CO2气体的不一定是CO32-,也有可能是HCO3-;B项,加入Mg(OH)2、MgO等物质能促使Fe3+的水解转化为沉淀而除去FeCl3,同时也不会引进新杂质;C项,根据现象,说明沉淀中有BaCO3,说明Ksp(BaCO3)>Ksp(BaSO4);D项,在此实验中,还有可能有副反应产生的SO2也能是高锰酸钾溶液褪色。综上分析可知,本题选B项。
[备考提示]溶度积Ksp反映了难溶电解质在水中的溶解能力,对于阴、阳离子个数比相同的物质来讲,Ksp的数值越小说明相应离子在水中越容易生成沉淀。
10.(2010上海卷)下列各组有机物只用一种试剂无法鉴别的是
A.乙醇、甲苯、硝基苯 B.苯、苯酚、己烯
C.苯、甲苯、环己烷 D.甲酸、乙醛、乙酸
答案:C
解析:此题考查了化学实验中的物质的检验知识。乙醇、甲苯和硝基苯中,乙醇可以和水互溶、甲苯不和水互溶但比水轻、硝基苯不和水互溶但比水重,可以鉴别,排除A;苯、苯酚和己烯可以选浓溴水,苯不和溴水反应、苯酚和浓溴水生成白色沉淀、己烯和溴水加成使其褪色,可以鉴别,排除B;苯、甲苯和环己烷三者性质相似,不能鉴别,选C;甲酸、乙醛、乙酸可以选新制氢氧化铜,甲酸能溶解新制氢氧化铜但加热时生成红色沉淀、乙醛不能溶解氢氧化铜但加热时生成红色沉淀、乙酸只能溶解氢氧化铜,可以鉴别,排除D。
知识归纳:进行物质的检验时,要依据物质的特殊性质和特征反应,选择适当的试剂和方法,准确观察反应中的明显现象,如颜色的变化、沉淀的生成和溶解、气体的产生和气味、火焰的颜色等,进行判断、推理。
(2010江苏卷)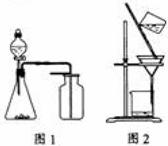 7.下列有关实验原理或操作正确的是
7.下列有关实验原理或操作正确的是
A.选择合适的试剂,用图1所示装置可分别制取少量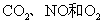
B.制备乙酸乙酯时,向乙醇中缓慢加入浓硫酸和冰醋酸
C.洗涤沉淀时(见图2),向漏斗中加适量水,搅拌并滤干
D.用广泛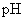 试纸测得0.10mol·L
试纸测得0.10mol·L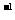 NH4Cl溶液的
NH4Cl溶液的
[答案]B
[解析]本题主要考查的是实验的基本知识。A项,不能用图1装置收集 ;B项,实验室制备乙酸乙酯时,先在试管中放入乙醇,在慢慢加入浓硫酸,冷却后,再加入乙酸;C项,洗涤沉淀,在过滤器中的沉淀中,加入蒸馏水,浸没沉淀,让水自然流下,不用玻璃棒搅拌;D项,W W W K S 5
U . C O M
;B项,实验室制备乙酸乙酯时,先在试管中放入乙醇,在慢慢加入浓硫酸,冷却后,再加入乙酸;C项,洗涤沉淀,在过滤器中的沉淀中,加入蒸馏水,浸没沉淀,让水自然流下,不用玻璃棒搅拌;D项,W W W K S 5
U . C O M
pH试纸只能测定溶液酸碱度的数值范围,但不能测得溶液具体的pH值。总是分析可知,本题选B项。
22.(2010广东理综卷)对实验Ⅰ~Ⅳ的实验现象预测正确的是
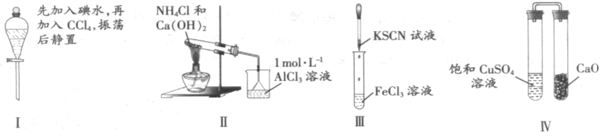
A 实验Ⅰ:液体分层,下层呈无色
B 实验Ⅱ:烧杯中先出现白色沉淀,后溶解
C 实验Ⅲ:试管中溶液颜色变为红色
D 实验Ⅳ:放置一段时间后,饱和CUSO4溶液中出现蓝色晶体
解析: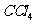 的密度比水大,下层呈紫红色,故A错;
的密度比水大,下层呈紫红色,故A错;
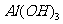 沉淀不能溶解于弱碱氨水中,故B错;
沉淀不能溶解于弱碱氨水中,故B错;
实验Ⅲ生产的血红色的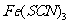 溶液,故C正确;
溶液,故C正确;
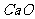 有一定的吸水性,能使饱和溶液中的水减少,有晶体析出,故D正确。
有一定的吸水性,能使饱和溶液中的水减少,有晶体析出,故D正确。
答案:CD
11.(2010浙江卷) 下列关于实验原理或操作的叙述中,不正确的是:
A. 从碘水中提取单质碘时,不能用无水乙醇代替CCl4
B. 可用新制的Cu(OH)2悬浊液检验牙膏中存在的甘油
C. 纸层析实验中,须将滤纸上的试样点浸入展开剂中
D. 实验室中提纯混有少量乙酸的乙醇,可采用先加生石灰,过滤后再蒸馏的方法
试题解析:
本题是一组实验操作或原理的正误判断问题。实验操作的正误,实际根源还是实验原理。A、乙醇和碘与水均互溶,不能作为萃取剂使用。考查萃取原理。B、新制Cu(OH)2悬浊液用来检验醛基而不是羟基。C、纸层析实验中,不能将滤纸上的试样点浸入展开剂中,否则式样会溶解在展开剂中。D、除乙酸用碱性氧化物,氧化钙还能吸水,过滤后利用乙醇沸点低的原理进行蒸馏最好。
本题答案:C
教与学提示:
本题涉及的化学实验都是重要的经典的。化学实验的教学中要重视重点实验的操作与原理,更要重视正确与错误的操作存在的与原理的矛盾。符合高中生理解记忆的特点,多想想为什么,才能顺利又高效掌握化学实验。实验教学还有:仪器链接、实验改进、数据处理、药品与仪器选择、药品添加顺序与药品用量、实验创新等内容。
18.(2010上海卷)右图是模拟氯碱工业生产中检查氯气是否泄漏的装置,下列有关说法错误的是
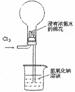 A.烧瓶中立即出现白烟
A.烧瓶中立即出现白烟
B.烧瓶中立即出现红棕色
C.烧瓶中发生的反应表明常温下氨气有还原性
D.烧杯中的溶液是为了吸收有害气体
答案:B
解析:此题考查化学实验、元素化合物的性质等知识。分析装置图,可知氨气和氯气接触时发生反应:4NH3+6Cl2=2NH4Cl+4HCl+N2,烧瓶中出现白烟,A对;不能出现红棕色气体,B错;该反应中氨气中的氮元素化合价升高,表现还原性,C对;烧杯中的氢氧化钠可以吸收多余的有害气体,D对。
知识归纳:对某种元素来讲,其处于最高价时,只有氧化性;处于最低价时,只有还原性;中间价态,则既有氧化性又有还原性。故此对同一种元素可以依据价态判断,一般来讲,价态越高时,其氧化性就越强;价态越低时,其还原性就越强;此题中氨气中的氮元素处于最低价,只有还原性。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com