
8.(2010江苏卷)下列说法不正确的是
A.铅蓄电池在放电过程中,负极质量减小,正极质量增加
B.常温下,反应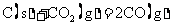 不能自发进行,则该反应的
不能自发进行,则该反应的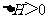
C.一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率
D.相同条件下,溶液中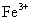 、
、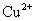 、
、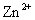 的氧化性依次减弱
的氧化性依次减弱
[答案]AC
[解析]本题主要考查的是相关的反应原理。A项,铅蓄电池在放电过程中,负极反应为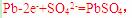 其质量在增加;B项,该反应是典型的吸热反应,在常温下不能自发进行;C项,催化剂能改变反应速率,不一定加快,同时它不能改变转化率;D项,
其质量在增加;B项,该反应是典型的吸热反应,在常温下不能自发进行;C项,催化剂能改变反应速率,不一定加快,同时它不能改变转化率;D项,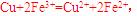 可知
可知 的氧化性大于
的氧化性大于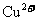 ,综上分析可知,本题选AC项。
,综上分析可知,本题选AC项。
12.(2010福建卷)化合物Bilirubin在一定波长的光照射下发生分解反应,反应物尝试随反应时间变化如右图所示,计算反应4~8 min间的平均反应速率和推测反应16 min 反应物的浓度,结果应是

A 2.5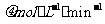 和2.0
和2.0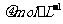
B 2.5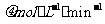 和2.5
和2.5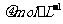
C 3.0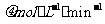 和3.0
和3.0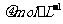
D 3.0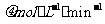 和3.0
和3.0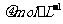
解析:本题考察化学反应速率的计算
第8秒与第4秒时反应物浓度差△C为10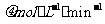 ,
, 为4秒,所以在4~8
为4秒,所以在4~8 间的平均反应速率为2.5
间的平均反应速率为2.5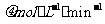 ,可以排除CD两个答案;图中从0
,可以排除CD两个答案;图中从0 开始到8
开始到8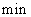 反应物浓度减低了4倍,根据这一幅度,可以推测从第8
反应物浓度减低了4倍,根据这一幅度,可以推测从第8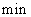 到第16分也降低4倍,即由10
到第16分也降低4倍,即由10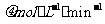 降低到2.5
降低到2.5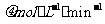 ,因此推测第16
,因此推测第16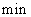 反应物的浓度为2.5
反应物的浓度为2.5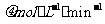 ,所以可以排除A而选B
,所以可以排除A而选B
答案:B
8.(2010福建卷)下列有关化学研究的正确说法是
A.同时改变两个变量来研究反映速率的变化,能更快得出有关规律
B.对于同一个化学反应,无论是一步完成还是分几步完成,其反应的焓变相同
C.依据丁达尔现象可将分散系分为溶液、胶体与浊液
D.从HF、HCl、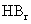 、HI酸性递增的事
、HI酸性递增的事 实,推出F、Cl、Br、I的非金属递增的规律
实,推出F、Cl、Br、I的非金属递增的规律
[解析]答案:B
本题侧重考查反应速率、盖斯定律、分散系、元素周期律重要的基本概念,规律
A. 同时改变两个变量来研究反应速率的变化,不容易判断影响反应速率的主导因素,因此更难得出有关规律
B. 这是盖斯定律的表述
C. 分散系的划分是以分散质颗粒大小来区分的
D. 在以酸性强弱作为判断元素非金属性非金属性强弱依据时,是以最高价氧化物对应水化物的酸性强弱为判断依据的。
10.(2010安徽卷)低脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:
2NH2(g)+NO(g)+NH2(g)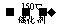 2H3(g)+3H2O(g)
2H3(g)+3H2O(g)  H<0
H<0
在恒容的密闭容器中,下列有关说法正确的是
A.平衡时,其他条件不变,升高温度可使该反应的平衡常数增大
B.平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小
C.单位时间内消耗NO和N2的物质的量比为1∶2时,反应达到平衡
D.其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大
答案:C
解析:A选项,放热反应升温平衡常数减小,错误;增大一个反应物浓度另一反应物转化率增大,B错;使用催化剂平衡不移动,D错。
10. 答案B
[解析]本题考查化学平衡的移动。该反应为体积增大的吸热反应,所以升温和减压均可以促使反应正向移动。恒压通入惰性气体,相当于减压。恒容通入惰性气体与加催化剂均对平衡无影响。增加CO的浓度,将导致平衡逆向移动。
[方法提炼]对于恒容容器,通入稀有气体,由于容器的体积不变,各组分的浓度保持不变,故反应速率保持不变,平衡也即不移动。若为恒压容器,通入稀有气体,容器的体积膨胀,对于反应则相当于减压。
10.(2010重庆卷)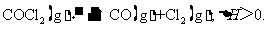 当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是
当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是
A.①②④ B.①④⑥ C.②③⑥ D.③⑤⑥
6.(2010天津卷)下列各表述与示意图一致的是
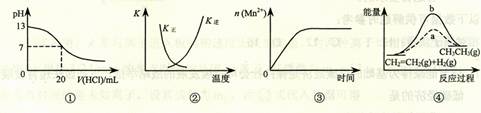
A.图①表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1 NaOH溶液,溶液的pH随加入酸体积的变化
B.图②中曲线表示反应2SO2(g) + O2(g)  2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化
2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化
C.图③表示10 mL 0.01 mol·L-1 KMnO4 酸性溶液与过量的0.1 mol·L-1 H2C2O4溶液混合时,n(Mn2+) 随时间的变化
D.图④中a、b曲线分别表示反应CH2=CH2 (g) + H2(g) CH3CH3(g);ΔH< 0使用和未使用催化剂时,反应过程中的能量变化
CH3CH3(g);ΔH< 0使用和未使用催化剂时,反应过程中的能量变化
解析:酸碱中和在接近终点时,pH会发生突变,曲线的斜率会很大,故A错;正逆反应的平衡常数互为倒数关系,故B正确;反应是放热反应,且反应生成的Mn2+对该反应有催化作用,故反应速率越来越快,C错;反应是放热反应,但图像描述是吸热反应,故D错。
答案:B
命题立意:综合考查了有关图像问题,有酸碱中和滴定图像、正逆反应的平衡常数图像,反应速率图像和能量变化图像。
8.能量转换装置的效率= ----------×100%
输入的总能量.
2009年物理中考复习---物理公式
|
 速度公式:
速度公式: 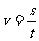
公式变形:求路程--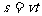 求时间--
求时间--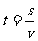

重力与质量的关系:
G = mg
合力公式: F = F1 + F2 [ 同一直线同方向二力的合力计算 ]
F = F1 - F2 [ 同一直线反方向二力的合力计算 ]
|
 密度公式:
密度公式:
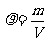
 浮力公式:
浮力公式:
F浮=G – F
|

F浮=G排=m排g
F浮=ρ水gV排

F浮=G
|

 压强公式:
压强公式:
p=

 液体压强公式:
液体压强公式:
p=ρgh
 帕斯卡原理:∵p1=p2 ∴
帕斯卡原理:∵p1=p2 ∴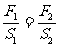 或
或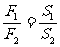


杠杆的平衡条件:
F1L1=F2L2
或写成: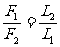
 滑轮组:
滑轮组:
F =
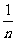 G总
G总

s =nh
对于定滑轮而言: ∵ n=1 ∴F = G s = h
对于动滑轮而言: ∵ n=2 ∴F = 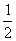 G s =2 h
G s =2 h
 机械功公式:
机械功公式:
 W=F s
W=F s
|
 功率公式:
功率公式:
P =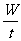

 机械效率:
机械效率:
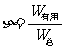 ×100%
×100%
热量计算公式:

物体吸热或放热
Q = c m △t
(保证 △t >0)
燃料燃烧时放热
 Q放= mq
Q放= mq

 ★电流定义式:
★电流定义式:
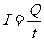


 欧姆定律:
欧姆定律:
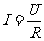


电功公式:
W = U I t

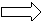 W = U I t
结合U=I R →→W = I 2Rt
W = U I t
结合U=I R →→W = I 2Rt
W = U I t 结合I=U/R →→W = 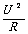 t
t
如果电能全部转化为内能,则:Q=W 如电热器。
 电功率公式:
电功率公式:
P = W /t


P = I U


串联电路的特点:
电流:在串联电路中,各处的电流都相等。表达式:I=I1=I2
电压:电路两端的总电压等于各部分电路两端电压之和。表达式:U=U1+U2
分压原理: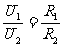
串联电路中,用电器的电功率与电阻成正比。表达式:
并联电路的特点:
电流:在并联电路中,干路中的电流等于各支路中的电流之和。表达式:I=I1+I2
分流原理: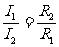
电压:各支路两端的电压相等。表达式:U=U1=U2
并联电路中,用电器的电功率与电阻成反比。表达式: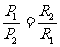
7.能量的转移和转化具有方向性。输出的有用能量
转换的能量
6.能量的转化和守恒定律:能量既不会凭空消灭,也不会凭空产生,它只会从一种形式转化为另一种形式,或者从一个物体转移到另一个物体,而在转化或转移的过程中,其总量保持不变。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com