
10.体积相同的甲、乙两个容器中,分别充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2+O2 2SO3并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率为( )
2SO3并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率为( )
A. 等于p% B. 大于p% C. 小于p% D. 无法判断
解析:根据题意,甲、乙两容器可设为如图所示装置。
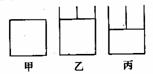
2SO2+O2 2SO3是一气体总物质的量减少的反应。甲容器保持体积不变,压强变小;乙容器保持压强不变,体积减小,达到平衡状态时转化为状态丙。假设乙中的活塞不移动,由于甲、乙两个容器的体积、温度相同,达到平衡时甲、乙两容器中存在的平衡是等效平衡,其中SO2的转化率也相等。对于乙和丙两个状态,乙中
2SO3是一气体总物质的量减少的反应。甲容器保持体积不变,压强变小;乙容器保持压强不变,体积减小,达到平衡状态时转化为状态丙。假设乙中的活塞不移动,由于甲、乙两个容器的体积、温度相同,达到平衡时甲、乙两容器中存在的平衡是等效平衡,其中SO2的转化率也相等。对于乙和丙两个状态,乙中 压强小于丙中压强,因此丙中SO2转化率大于乙中SO2转化率。由此可以判断出丙中SO2的转化率也大于甲中SO2的转化率。
压强小于丙中压强,因此丙中SO2转化率大于乙中SO2转化率。由此可以判断出丙中SO2的转化率也大于甲中SO2的转化率。
答案:B。
9. 可逆反应A(g)+B(g)
可逆反应A(g)+B(g) 2C(g)在固定容积的容器中进行,如果向容器中充入1mol A和1mol B,在某温度下达到平衡时,C的体积分数为m%;若向容器中充入1mol C,在同样的温度下达到平衡时,C的体积分数为n%,则m和n的关系正确的是( )
2C(g)在固定容积的容器中进行,如果向容器中充入1mol A和1mol B,在某温度下达到平衡时,C的体积分数为m%;若向容器中充入1mol C,在同样的温度下达到平衡时,C的体积分数为n%,则m和n的关系正确的是( )
A. m>n B. m<n C. m=n D. 无法比较
解析:在恒温恒容条件下,对于反应前后气体分子数不变的可逆反应,只要按化学计量数换算成平衡式左右两边同一边物质的物质的量之比与原平衡相同,则二平衡也为等效平衡。假设1mol C物质完全反应,可以生成0.5mol A和0.5mol B,投入量是第一种投料方式的一半,所以压强也是其一半。但由于该反应是一个气体体积不变的反应,即压强对该反应的平衡状态没有影响,所以前后两个平衡仍然是等效平衡。因此两个平衡中C的体积分数相等。正确答案为C。但在第二个平衡状态中C的浓度是第一个平衡状态的一半。
答案:C
8.在一个体积固定的密闭容器中加入2 mol A和1 mol B,发生反应:
2A(g)+B(g) 3C(g)+D(g),达到平衡时C的浓度为a mol·L-1。若维持容器体积和温度不变,按下列四种配比作为起始物质,达到平衡后,C的浓度仍为a mol·L-1的是( )
3C(g)+D(g),达到平衡时C的浓度为a mol·L-1。若维持容器体积和温度不变,按下列四种配比作为起始物质,达到平衡后,C的浓度仍为a mol·L-1的是( )
A. 4molA+2molB
 B. 2molA+1molB+3molC+1molD
B. 2molA+1molB+3molC+1molD
C. 3molC+1molD+1molB D. 3molC+1molD
7.可逆反应N2+3H2 2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达到平衡状态的是( )
2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达到平衡状态的是( )
A.3v正(N2)=v正(H2) B.v正(N2)=v逆(NH3)
C.2v正(H2)=3v逆(NH3) D.v正(N2)=3v逆(H2)
解析:对于可逆反应“N2+3H2  2NH3”,正反应速率可以用H2、N2、NH3三种物质的浓度变化来表示,逆反应速率也可用H2、N2、NH3三种物质的浓度变化来表示。对于同一反应、同一时刻的正反应速率(或逆反应速率),用不同物质的浓度变化来表示时,其大小关系跟化学计量数有关,即有:v正(N2):v正(H2):v正(NH3)=1
2NH3”,正反应速率可以用H2、N2、NH3三种物质的浓度变化来表示,逆反应速率也可用H2、N2、NH3三种物质的浓度变化来表示。对于同一反应、同一时刻的正反应速率(或逆反应速率),用不同物质的浓度变化来表示时,其大小关系跟化学计量数有关,即有:v正(N2):v正(H2):v正(NH3)=1 :3:2或v逆(N2):v逆(H2):v逆(NH3)=1:3:2。所以,当2v正(H2)=3v逆(NH3)时,处于化学平衡状态。
:3:2或v逆(N2):v逆(H2):v逆(NH3)=1:3:2。所以,当2v正(H2)=3v逆(NH3)时,处于化学平衡状态。
答案:B。
6.根据下图判断,正确是是( )

A.反应物中一定有气体 B.生成物中一定无气体
C.正反应一定是放热反应 D.正反应一定是吸热反应
解析:定一议二,当图像中有三个量时,先确定一个量不变再讨论另外两个量的关系。温度不变时,增大压强,生成物的百分含量降低,说明平衡逆向移动,逆向为体积缩小方向,而题中未给出具体的可逆反应,但是可以确定生成物中一定有气体;压强不变时,升高温度,生成物的百分含量增大,说明平衡正向移动,正向为吸热反应。
答案:D。
5. 10 mL 2mol/LH2SO4(aq)跟足量铁粉反应,在一定温度下,为了减缓反应进行的速率,但又不影响生成H2的总量,可向反应物中加入适量的( )
A. K2CO3(s) B. 水 C. H 2SO4(aq) D.(NH4)2SO4(s)
解析:因为是足量锌粉,所以氢气的多少决定于硫酸,所以不能改变氢离子的量,加入水不会引起氢离子变化,但加水氢离子浓度降低,减缓反应速率;A消耗氢离子,产生氢气少;C增加氢离子,产生氢气多;D是强酸弱碱盐,铵根水解,引起氢离子浓度增加。
答案:B
4.下列判断正确的是( )
A. 0.1mol/L盐酸和0.1mol/L醋酸分别与0.2mol/L氢氧化钠溶液反应的速率相同
B. 0.1mol/L盐酸和0.1mol/L硝酸分别与大小相同的大理石反应的速率不同
C. 铝和铁分别与0.1mol/L硫酸的反应速率相同
D. 大理石块与大理石粉末分别与0.1mol/L盐酸反应的速率不同
解析:A中醋酸是弱电解质,溶液中氢离子的浓度小,所以速率慢;B中盐酸和硝酸与大理石反应的速率相同;C中铝的金属性强于铁,反应速率更快。
答案:D
3. 反应4A(s)+3B(g)
反应4A(s)+3B(g) 2C(g)+D(g),经2min,B的浓度减少0.6mol/L,对此反应速率的表示,正确的是( )
2C(g)+D(g),经2min,B的浓度减少0.6mol/L,对此反应速率的表示,正确的是( )
A. 用A表示的反应速率是0.4 mol·L-1·min-1
B. 分别用B、C、D表示反应速率,其比值是3:2:1
C. 在2min末的反应速率,用 B表示是0.3 mol·L-1·min-1
B表示是0.3 mol·L-1·min-1
D. 在这2min内用B和C表示的反应速率的值都逐渐减小
解析: A应是0.8 mol·L-1·min-1;C应是平均速率,而不是2min末的瞬时速率;D中C表示生成物,速率应是不断增大。
答案:B
2.下列条件一定能使反应速率加快的是( )
① 增加反应物的物质的量;② 升高温度;③ 缩小反应容器的体积;④ 加入生成物;⑤ 加入MnO2
A. 全部 B. ①②⑤ C. ② D. ②③
1. 决定化学反应速率的根本因素是( )
A. 温度和压强
 B. 反应物的浓度
B. 反应物的浓度
C. 参加反应的各物质的性质 D. 催化剂的加入
解析:参加化学反应的物质的性质是决定化学反应速率的主要原因,其他为外因。
答案:C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com