
18.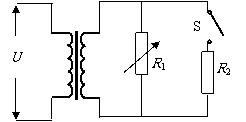 如图所示为一理想变压器,在原线圈输入电压不变的条件下,要提高变压器的输入功率,可采用的方法是
如图所示为一理想变压器,在原线圈输入电压不变的条件下,要提高变压器的输入功率,可采用的方法是
A只增加原线圈的匝数
B只增加副线圈的匝数
C只减小用电器R1的电阻
D断开开关S
17.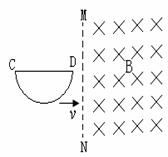 如图所示,一导线弯成半径为a的半圆形闭合回路。虚线MN右侧有磁感应强度为B的匀强磁场。方向垂直于回路所在的平面。回路以速度v向右匀速进入磁场,直径CD始终与MN垂直。从D点到达边界开始到C点进入磁场为止,下列结论不正确的是
如图所示,一导线弯成半径为a的半圆形闭合回路。虚线MN右侧有磁感应强度为B的匀强磁场。方向垂直于回路所在的平面。回路以速度v向右匀速进入磁场,直径CD始终与MN垂直。从D点到达边界开始到C点进入磁场为止,下列结论不正确的是
A感应电流方向不变
B CD段直线始终不受安培力
C感应电动势最大值E=Bav
D感应电动势平均值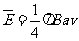
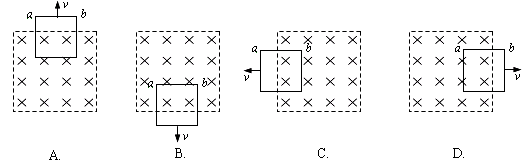
16.粗细均匀的电阻丝围成的正方形线框置于有界匀强磁场中,磁场方向垂直于线框平面,其边界与正方形线框的边平行。现使线框以同样大小的速度沿四个不同方向平移出磁场,如图所示,则在移出过程中线框一边a、b两点间的电势差绝对值最大的是
15.如图所示为汽车蓄电池与车灯(电阻不变)、启动电动机组成的电路,蓄电池内阻为0.05Ω,电流表和电压表均为理想电表.只接通S1时,电流表示数为10A,电压表示数为12V,再接通S2,启动电动机工作时,电流表示数变为8A,则此时通过启动电动机的电流是
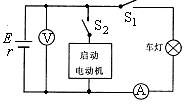 A 2A
A 2A
B 8A
C 50A
D 58A
14.用如图所示的方法可以研究不同人的反应时间,设直尺从静止开始自由下落到直尺被受测者抓住,直尺下落的竖直距离为h,受测者的反应时间为t,则下列关于t和h的关系正确的是
A t ∝h
 B t ∝
B t ∝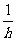
C
t ∝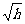
D t ∝h2
13.下列溶液中有关微粒的物质的量浓度关系正确的是
A.0.20mol·L-1Na2CO3溶液和0.20mol·L-1NaHCO3溶液等体积混合后:
c(Na+)+C(H+)=C(OH-)+c(HCO3-)+c(CO32-)
B.常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:
c(Na+)>c(Cl-)>c(CH3COOH)
C.常温下三种溶液①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2中含有NH4+的物质的量浓度相等,则三种溶液中溶质的物质的量浓度大小关系为:①<③<②
D.向0.10mol·L-1硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+)=c(NO3-)
12.某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+xB(g) 2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化如下图所示。下列说法中正确的是
2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化如下图所示。下列说法中正确的是
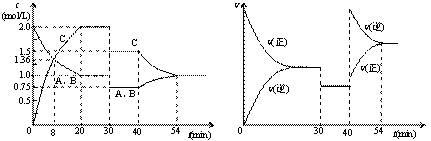
A.30min时降低温度,40min时充入生成物C
B.0-8min内A的平均反应速率为0.08mol/(L·min)
C.反应方程式中的x=1,正反应为吸热反应
D.20min-40min间该反应的平衡常数均为8
11. 已知:①向KMnO4晶体滴加浓盐酸,产生黄绿色气体;②向FeCl2溶液中通入少量实验①产生的气体,溶液变黄色;③取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色。下列判断正确的是
A.上述实验证明氧化性:MnO4->Cl2>Fe3+>I2
B.上述实验中,共有两个氧化还原反应
C.实验①生成的大量气体能使湿润的淀粉KI试纸最终变蓝
D.实验②证明Fe2+既有氧化性又有还原性
10.下列离子方程式书写正确的是
A. 在氢氧化钡溶液中加入少量的硫酸氢钠溶液:
Ba2+ + 2 OH-+ 2 H + + SO42- = BaSO4↓ + 2 H2O
B. 标准状况下,112mL氯气通入10mL 0.1mol/L溴化亚铁溶液中
3Cl2+2Fe2++4Br-====6Cl-+2Fe3++2Br2
C.酸性条件下KIO3溶液和KI溶液反应生成I2:IO3-+5I-+3H2O=3I2+6OH-
D. NaAlO2溶液中通入足量CO2制Al(OH)3:2AlO2-+ CO2+3H2O = 2Al(OH)3↓ +CO32-
9.下表中的实验,“操作和现象”与“结论”对应关系正确的一组是
|
|
操作和现象 |
结论 |
|
A |
向纯碱中滴加足量浓盐酸,将所得气体通入苯酚钠溶液中, 溶液变浑浊 |
酸性:盐酸>碳酸>苯酚 |
|
B |
取某溶液少量,加入盐酸酸化的BaCl2溶液,出现白色沉淀 |
该溶液中一定含有大量的SO42- |
|
C |
取少量Fe(NO3)2试样加水溶解后加稀H2SO4酸化,滴加KSCN溶液,溶液变为红色 |
该Fe(NO3)2试样已经变质 |
|
D |
取皂化反应后的混合液滴入盛水的烧杯中,在液体表面出现油滴 |
皂化反应不完全 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com