
8. 《新唐书》载:“是时,可汗上书恭甚,言!昔为兄弟,今婿,半子也。陛下若患西戎,予请以兵除之。”从材料中能够得出的正确信息是 ( )
《新唐书》载:“是时,可汗上书恭甚,言!昔为兄弟,今婿,半子也。陛下若患西戎,予请以兵除之。”从材料中能够得出的正确信息是 ( )
A.唐与突厥关系紧张 B.南诏接受唐朝领导
C.回纥与唐朝关系亲密 D.唐政府与吐番和亲
5. 唐朝和宋代在处理民族关系方面影响的相似之处有( )
①有利于少数民族封建化
②经济文化交流不断加 强
强
③民族友好是发展的主流 ④中央政权在居于主导地位
A.①② B. ②③ C.①②③ D. ①②③④
4. 隋唐之际北方游牧民族中势力最强大的是( )
A.匈奴 B.鲜卑 C.突厥 D.乌桓
3. 唐朝中期以后实行的两税法同以前的租庸调制相比,最主要的变化是 ( )
A.地租形式的变化 B.赋税种类的变化
C.征税标准的改变 D.税务手续的简化
两税法是我国古代赋税制度的一次重大改革。实行这一改革的直接原因是( )
A.加强对百姓的控制与管理 B.土地兼并情况十分严重
C.冗官、冗兵、冗费致使政府财政困难 D.适应商品经济发展的需要
2. 唐初,每事先经由中书省,中书做定将上,得者再下中书,中书付门下。或有未当,则门下缴驳,又上中书,中书又将上,得者再下中书,中书又下门下。若事可行,门下即下尚书省。尚书省但主书填“奉行”而已。对此下列叙述正确的是( )
A.中央官制设置重叠,冗官现象严重 B.中央官制高度完备,行政效率提高
C.皇权进一步加强,各部门都有决策权 D.加强了中央集权,削弱了地方的势力
唐太宗在《诫皇属》中提到;“先贤有言:‘逆吾者是吾师,顺吾者是吾贼’。不可不察也。”以下选项最 能体现唐太宗这一思想的是
( )
能体现唐太宗这一思想的是
( )
A.知人善任,虚怀纳谏 B.以儒为师,大办学校
C.厚之以德,抚之以仁 D.轻徭薄赋,戒奢从俭
1. 钱穆在《中国历代政治得失》中说:“汉代宰相是首长制”,一人之下、万人之上。唐朝时,这种状况发生了改变,表现为( )
A.宰相有名无实 B.实行了内阁制
C.废除了宰相 D.设立多个宰相职位
17.(2010江苏卷)(8分)下表列出了3种燃煤烟气脱硫方法的原理。

(1)
方法Ⅰ中氨水吸收燃煤烟气中 的化学反应为:
的化学反应为:
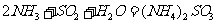


能提高燃煤烟气中 去除率的措施有 ▲ (填字母)。
去除率的措施有 ▲ (填字母)。
A.增大氨水浓度
B.升高反应温度
C.使燃煤烟气与氨水充分接触
D. 通入空气使 转化为
转化为
采用方法Ⅰ脱硫,并不需要预先除去燃煤烟气中大量的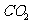 ,原因是▲(用离子方程式表示)。
,原因是▲(用离子方程式表示)。
(2) 方法Ⅱ重要发生了下列反应:
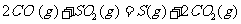

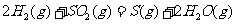


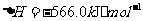
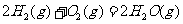
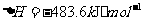
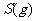 与
与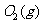 反应生成
反应生成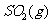 的热化学方程式为
。
的热化学方程式为
。
(3)
方法Ⅲ中用惰性电极电解 溶液的装置
溶液的装置
如右图所示。阳极区放出气体的成分为 。
(填化学式)
[答案]
(1)AC
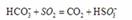
(2)S(g)+O2(g)= S O2(g) H=-574.0kJmol-1
(3) O2 SO2
[解析]本题考察的知识比较散,涉及到环境保护,一道题考察了几个知识点。覆盖面比较多。但盖斯定律、热化学方程式、离子方程式、点击方程式都是重点内容(1)提高SO2的转化率,可以增大氨水的浓度、与氨水充分接触;不需要通入CO2的原因是因为HCO3+SO2=CO2+HSO3而产生CO2 (2)主要考察盖斯定律的灵活运用。适当变形,注意反应热的计算。不要忽视热化学方程式的书写的注意事项。(3)阴极的电极产生的气体为O2和SO2.
25.(2010上海卷)接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:
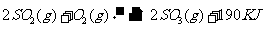
1)该反应所用的催化剂是 (填写化合物名称),该反应450℃时的平衡常数 500℃时的平衡常数(填“大于”、“小于”或“等于”)。
2)该热化学反应方程式的意义是 .
a. b.容器中气体的平均分子量不随时间而变化
b.容器中气体的平均分子量不随时间而变化
c.容器中气体的密度不随时间而变化 d.容器中气体的分子总数不随时间而变化
4)在一个固定容积为5L的密闭容器中充入0.20
mol SO2和0.10molSO2,半分钟后达到平衡,测得容器中含SO30.18mol,则 = mol.L-1.min-1:若继续通入0.20mol SO2和0.10mol O2,则平衡 移动(填“向正反应方向”、“向逆反应方向” 或“不”),再次达到平衡后, mol<n(SO3)< mol。
= mol.L-1.min-1:若继续通入0.20mol SO2和0.10mol O2,则平衡 移动(填“向正反应方向”、“向逆反应方向” 或“不”),再次达到平衡后, mol<n(SO3)< mol。
答案:1)五氧化二钒(V2O5);大于;2)在450℃时,2molSO2气体和1molO2气体完全反应生成2molSO3气体时放出的热量为190kJ;3)bd;4)0.036;向正反应方向;0.36;0.40。
解析:此题考查了工业制硫酸、化学平衡常数、热化学方程式、化学平衡状态、有关化学平衡的计算等知识。1)工业制硫酸时二氧化硫催化氧化使用的催化剂是五氧化二钒;该反应正向放热,故温度越高化学平衡常数越小;2)热化学方程式表示的是450℃时,2molSO2气体和1molO2气体完全反应生成2molSO3气体时放出的热量为190kJ;3)根据化学平衡状态的特征,容器中气体的平均相对分子质量不随时间变化、分子总数不随时间变化时,说明反应达到平衡状态;4)当达到平衡时,容器中SO3的物质的量为0.18mol,则v(SO3)=0.072mol.L-1.min-1,则v(O2)=0.036mol.L-1.min-1;再继续通入0.20molSO2和0.10molO2时,平衡向正反应方向移动,在此达到平衡时,SO3的物质的量介于0.36和0.40之间。
知识归纳:化学平衡常数只是和温度相关的函数,其随温度变化而变化。若正反应为吸热反应,温度升高K值增大;若正反应为放热反应,温度升高K值减小。
23.(2010福建卷)(15分)
J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如右表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素。
(1)M的离子结构示意图为_____;元素T在周期表中位于第_____族。
(2)J和氢组成的化合物分子有6个原子,其结构简式为______。
(3)M和T形成的化合物在潮湿的空气中冒白色烟雾,反应的化学方程式为_____。
(4)L的最简单气态氢化物甲的水溶液显碱性。
①在微电子工业中,甲的水溶液可作刻蚀剂H2O2 的清除剂,所发生反应的产物不污染环境,其化学方程式为______。
②一定条件下,甲在固定体积的密闭容器中发生分解反应(△H>0)并达平衡后,仅改变下表中反应条件x,该平衡体系中随x递增y递减的是_______(选填序号)。
|
选项 |
a |
b |
c |
d |
|
x |
温度 |
温度 |
加入H2的物质的量 |
加入甲的物质的量 |
|
y |
甲的物质的量 |
平衡常数K |
甲的转化率 |
生成物物质的量总和 |
(5)由J、R形成的液态化合物JR2 0.2mol在O2中完全燃烧,生成两种气态氧化物,298K时放出热量215k J。
该反应的热化学方程式为________。
J。
该反应的热化学方程式为________。
解析:
(1) J元素最低负化合价的绝对值与其原子最外层电子数相等,可以判断J元素为碳元素;M是地壳中含量最多的金属元素为铝元素;根据J、R在周期表中的相对位置可以判断R为硫元素,则T为氯元素,处于第三周期第七主族
(2)J和氢组成含有6个原子的分子为乙烯,其结构简式为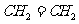
(3)M和T形成的化合物为 ,与水反应
,与水反应 ,其中氯化氢气体呈雾状
,其中氯化氢气体呈雾状
(4)①氨水与双氧水发生氧化还原反应:
生成无污染的氮气;
②甲在固体体积的密闭容器中发生分解反应 ,
, 表明正反应为吸热反应,升高温度,平衡朝着正方向移动,甲物质的量减少;加入
表明正反应为吸热反应,升高温度,平衡朝着正方向移动,甲物质的量减少;加入 的物质的量即增加生成物的浓度,平衡朝逆方向移动,甲的转化率减小
的物质的量即增加生成物的浓度,平衡朝逆方向移动,甲的转化率减小
(5)JR2为CS2,燃烧生成二氧化碳和二氧化硫,依题意可以很快的写出反应的热化学方程式

答案:(1)  ;
ⅦA
;
ⅦA
(2)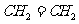
(3) ,
,
(4)①
②a和c;a或c
(5)

31.(2010广东理综卷)(16分)硼酸(H3BO3)在食品、医药领域应用广泛。
(1)请完成B2H6气体与水反应的化学方程式:B2H6 + 6H2O=2H3BO3 +________。
(2)在其他条件相同时,反应H3BO3 +3CH3OH B(OCH3)3
+3H2O中,H3BO 3的转化率(
B(OCH3)3
+3H2O中,H3BO 3的转化率(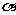 )在不同温度下随反应时间(t)的变化见图12,由此图可得出:
)在不同温度下随反应时间(t)的变化见图12,由此图可得出:
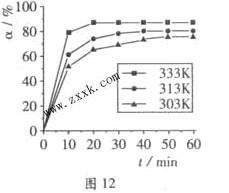
①温度对应该反应的反应速率和平衡移动的影响是____ ___
②该反应的 _____0(填“<”、“=”或“>”).
_____0(填“<”、“=”或“>”).
(3)H3BO 3溶液中存在如下反应:
H3BO 3(aq)+H2O(l) [B(OH)4]-(
aq)+H+(aq)已知0.70 mol·L-1 H3BO
3溶液中,上述反应于298K达到平衡时,c平衡(H+)=2.
0 × 10-5mol·L-1,c平衡(H3BO 3)≈c起始(H3BO 3),水的电离可忽略不计,求此温度下该反应的平衡常数K(H2O的平衡浓度不列入K的表达式中,计算结果保留两位有效数字)
[B(OH)4]-(
aq)+H+(aq)已知0.70 mol·L-1 H3BO
3溶液中,上述反应于298K达到平衡时,c平衡(H+)=2.
0 × 10-5mol·L-1,c平衡(H3BO 3)≈c起始(H3BO 3),水的电离可忽略不计,求此温度下该反应的平衡常数K(H2O的平衡浓度不列入K的表达式中,计算结果保留两位有效数字)
解析:(1)根据元素守恒,产物只能是H2, 故方程式为B2H6 + 6H2O=2H3BO3 +6H2。
(2)由图像可知,温度升高,H3BO 3的转化率增大,故升高温度是平衡正向移动,正反应是吸热反应,△H>O。
(3) K= =
=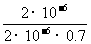 =
=
答案:
(1) B2H6 + 6H2O=2H3BO3 +6H2
(2) ①升高温度,反应速率加快,平衡正向移动 ②△H>O
(3)  或1.43
或1.43
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com