
2.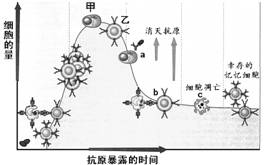 右图是有关抗原进入人体后引发的特异性免疫的过程。下列有关叙述不正确的是
右图是有关抗原进入人体后引发的特异性免疫的过程。下列有关叙述不正确的是
A.甲细胞代表能够分泌抗体的效应B细胞
B.乙细胞代表能够识别靶细胞的效应T细胞
C.a和b分别代表体液免疫和细胞免疫,两者共同作用消灭抗原
D.c过程表示特异性免疫细胞凋亡,保留下的细胞发育成为记忆细胞
3.下列有关生物体化学成分的叙述正确的是
A.马铃薯中含量最多成分是淀粉 B.决定HIV抗原特异性的成分是RNA
C.糖原代谢的最终产物是葡萄糖 D.动物胞间连接主要成分的单体是氨基酸
1.在生产面包和啤酒的过程中都有利用酵母进行酒精发酵。下列论述中正确的
A.酵母进行发酵是因为它们的细胞中没有线粒体的缘故
B.每产生1分子乙醇,就会有1分子CO2释放
C.糖酵解是发酵的主要过程,能产生少量的ATP
D.生产啤酒时会有CO2的释放,用发酵法生产面包则不会产生
30.(8分)把经过烘干的木炭粉未和氧化铜粉未混合均匀,小心地铺放进试管,并将试管固定在铁架台上。用酒精灯加热混合物一段时间后,有气体X产生。请你探究气体X的成分。
(1)提出合理假设
假设1: ; 假设2: ;假设3:同时含有CO和CO2。
(2)设计实验方案证明“假设3”成立(不用在答题卡上作答)
(3)实验过程
根据(2)中方案进行实验。在答题卡上按下表的格式写出实验步骤、预期现象与结论。
|
实验步骤 |
预期现象与结论 |
|
步骤1: |
|
|
步骤2: |
|
29.(7分)固体A中可能含有Na2SO4、CuSO4、Na2CO3、NaCl、NaNO3中的一种或几种,进行如下实验,观察、记录现象如下表:
|
实验步骤及现象 |
|
① 取少许固体A放到烧杯中,加适量水溶解,得到无色溶液B。 |
|
② 取少量B溶液于试管中,滴加足量稀盐酸时,有气泡产生。反应结束后得到溶液C。 |
|
③ 取少量C溶液于试管中,加入足量BaCl2溶液,生成白色沉淀。 |
|
④ 取少量C溶液于试管中,加入足量AgNO3溶液,生成白色沉淀。 |
你的结论是:A中一定没有 ;A中一定有 ,A中可能有
步骤②反应的化学方程式为
步骤③反应的化学方程式为
28.(4分)自行车防雨棚采用了钢架结构,但使用不久就会生锈。某校的研究小组通过实验进行铁制品锈蚀条件的探究,了解铁制品锈蚀的条件,得到防止自行车棚的钢架锈蚀一些方法。
(1)铁制品锈蚀条件的探究
实验步骤:将三根洁净光亮的铁钉分别放入三支试管中。
在Ⅰ试管中倒入蒸馏水至浸没1/2的铁钉;
在Ⅱ试管中倒入经煮沸迅速冷却的蒸馏水,使蒸馏水浸没铁钉,并再倒入适量植物油;
在Ⅲ试管中放入棉花和干燥剂,并塞上塞子。
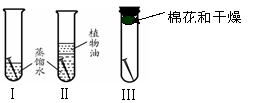 实验装置:
实验装置:
|
|
铁钉锈蚀的条件 |
一周后的实验现象 |
|
试管Ⅰ |
|
铁钉表面生成一层红褐色的铁锈,位于水面和空气交界面的部分,生成的铁锈最厚。 |
|
试管Ⅱ |
|
铁钉表面没有明显的锈斑 |
|
试管Ⅲ |
|
铁钉仍光亮完好 |
实验结论: 。
27.(8分)粗盐中含有较多量的可溶性杂质(MgCl2、CaCl2)和不溶性杂质(泥沙等)。某兴趣小组称出粗盐样品质量为5.0g,进行粗盐提纯。


A B
(1)室温为20℃,氯化钠的溶解度为36.0g。计算5.0g粗盐,至少需要加水的质量为
(2)粗盐溶解后要过滤,选用的装置是 ;过滤之后澄清溶液中含有的溶质是
(3)蒸发
(4) 计算产率:用玻璃棒将所得精盐转移到纸片上,称量其质量为3.8g,则精盐产率是 。
小明觉得产率偏低,请你帮他分析原因,写出两点即可:
;
。
26.(6分)下图是实验室制取二氧化碳和收集二氧化碳的装置,据图回答下列问题。
(1)写出图中标号仪器的名称。
A是 ,B是 ,C是 。
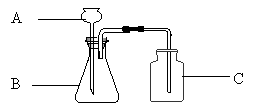
(2)仪器连接好以后,必须先检查装置的 ,再装入药品,该操作的方法是 。
25.(6分)“低碳生活”是指生活作息时所耗用能量要减少,从而减低碳特别是二氧化碳的排放。
(1)下列属于“低碳生活”方式的是
A.多建燃烧煤的火电厂,以保证电力的供应
B.日常生活中要少用化石燃料,多用电
C.将呼吸产生的二氧化碳用石灰水吸收
D.改善现在使用的能源,大力发展太阳能,氢能等
(2)为减缓二氧化碳引起的温室效应,有人提出设想:将排放到空气中的二氧化碳液化后压入深海,但二氧化碳会使海水酸度增加,其中酸度增加的原理是(写化学方程式) 。
(3)资料表明,二氧化碳可综合利用,如工业生产中,用二氧化碳和氨气在一定件下可以生成高效的氮肥尿素[CO(NH2)2],则尿素中碳、氮、氢、氧元素的质量比为_____________,尿素中氮元素的质量分数是 ,300吨尿素含氮元素质量为 吨。
24. (7分)中和反应在日常生活和工农业生产中有广泛的应用。
(1)在烧杯中加入10mL氢氧化钠溶液,滴入几滴酚酞溶液后,再用滴管慢慢滴入稀盐酸至溶液颜色恰好变成无色为止,此时烧杯中溶液的pH是 7。(填大于\小于\等于)
发生反应的化学方程式为 。
(2)右图是硫酸滴入氢氧化钠溶液中有关粒子之间反应的示意图。由图1中可知:
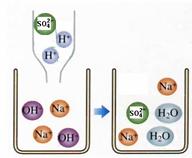 硫酸电离方程式为
;
硫酸电离方程式为
;
由图2中可知硫酸与氢氧化钠能发生反应的原因
是 。
(3)为了测定某工厂废水中硫酸的含量,取100g废水于烧杯中,加入160g质量分数为10%的氢氧化钠溶液,恰好完全反应(废水中无不溶物,其它成分不与氢氧化钠反应)。请计算:参加反应的硫酸与氢氧化钠的质量比是 ;废水中硫酸的质量分数是 。
23.(4分)钢铁是重要的金属材料,在生产、生活中有广泛的用途。炼铁厂常以焦炭、赤铁矿(主要成分是Fe2O3)、空气等为主要原料炼铁,反应过程如下:

焦炭 CO2 CO Fe
请回答:
(1)赤铁矿主要成分Fe2O3中铁元素的化合价是 ;
(2)第②步的化学反应基本类型属于 ;
(3)第③步反应的化学方程式:_____________________,其中属于还原剂的物质是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com