
32.(每空1分,共7分)(合理均给分)
|
实验 |
现象 |
解释 |
|
|
|
① 澄清石灰水 ;CO2
+Ca(OH) 2 = CaCO3↓+ H2O ② 稀硫酸 ③ B ;实验A的溶液中已有水,此实验可以证明水不能使碳酸盐产生无色气体。 |
氢离子和碳酸根离子;AC或AD
33.(6分)铝和氧化铁的反应:2Al + Fe2O3 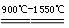 Al2O3+ 2Fe ,该反应可用于焊接铁轨。某小组取铝粉和氧化铁混合物使之充分反应,反应中放出大量的热并发出耀眼的光芒,同时有熔融物生成。该小组对所得熔融物的成分进行了探究。
Al2O3+ 2Fe ,该反应可用于焊接铁轨。某小组取铝粉和氧化铁混合物使之充分反应,反应中放出大量的热并发出耀眼的光芒,同时有熔融物生成。该小组对所得熔融物的成分进行了探究。
[查阅资料]
|
物质 |
Al |
Al2O3 |
Fe |
Fe2O3 |
|
熔点/℃ |
660 |
2054 |
1535 |
1462 |
|
沸点/℃ |
2467 |
2980 |
2750 |
|
[实验猜想]甲同学推测熔融物中含有铁和铝。若甲同学的推测成立,其理由是
。
[实验验证]
⑴请你帮助甲同学完成验证报告。
|
实验步骤 |
实验现象 |
实验结论 |
|
取少量的熔融物于试管中,加入
|
固体全部溶解、有无色气体逸出、 |
熔融物含有铁和铝 |
⑵ 乙同学认为甲同学的实验方案不严谨,又用定量的方法帮助他进一步验证。取4.6g该熔融物于烧杯中,滴加a g稀硫酸时恰好完全反应,称得反应后溶液的质量为(a + 4.4)g。反应后的溶液经处理后得到19.0g的固体。通过实验,乙同学得出甲同学的猜想成立,理由是 。
32.(宣武)(7分)含碳酸根的盐与某些酸反应会产生无色气体。某同学欲从微观角度探究该类反应的变化原因,进行了如下实验:
资料:多数酸、碱、盐在水溶液中均以离子形式存在,如Na+、K+、H+、NO3-、CO32-、SO42-等;且阴阳离子相互作用可形成相应化合物。
|
实 验 |
现 象 |
解释 |
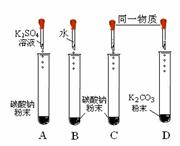 |
A、B
、C、D中的固体全部溶解 C、D产生同一种无色气体 |
①检验无色气体可选用的试剂是 ,写出检验该气体的化学方程式 。 ② C、D中应加入的物质是_ 。 ③上述实验中,没必要做的实验 是 (填实验序号),理由是 。 |
实验结论:决定该类反应产生气体的微粒是 。能证明此结论实验有
(填实验序号)。
33.(7分)
⑴ 若酚酞试剂变质,就不可能出现遇氢氧化钠溶液变红的现象
⑵ 碳酸钠溶液显碱性,也可使酚酞溶液变红
⑶ ①排出水中溶解的氧气 ②隔绝空气
⑷ 方案一:与氢氧化钠溶液质量分数有关
方案二:将滴有酚酞溶液且质量分数大的氢氧化钠溶液加水稀释
或做对比实验,取质量分数大的NaOH溶液加水稀释后,滴入酚酞溶液
⑸ B
32.(7分)
⑴ ⑥ ① 溶液不变浑浊(答案合理就即可) CO ⑵ a、d b、c Na2CO3+2HCl==2NaCl+ H2O+ CO2↑ 或:Na2CO3+H2SO4= Na2SO4+H2O+CO2↑
32.(7分)用下面的装置将一定量的CO2和CO的混合气体进行分离和干燥。图中的a、b、c、d均为活塞,可以控制气体的通过和液体的加入,实验前活塞均已关闭。请选择适宜的试剂完成上述实验。(仪器的固定装置已经省略)

可供选择的试剂有:①浓硫酸 ②稀硫酸 ③浓盐酸
④稀盐酸 ⑤澄清的石灰水 ⑥氢氧化钠溶液
实验分以下两步进行:(所选的试剂均用序号表示)
⑴ 关闭b、c,打开a、d,则甲中试剂为 ,丙中试剂为 。若乙装置中的现象是 ,说明甲装置中反应是充分的。 此步实验后收集到的气体是 。
⑵ 在甲装置的分液漏斗中加入试剂②或④,关闭活塞 (填写序号,下同),打开活塞 ,再经过丙装置后即可收集到另一种气体。此步实验中发生的反应方程式为 。
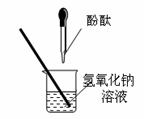 33.(7分)同学们在探究碱溶液与酚酞溶液作用的实验时,发现了一个意外现象:向氢氧化钠溶液中滴入酚酞溶液(如图),溶液变成了红色,但是一会儿红色就消失了。为此某化学小组的同学进行了如下探究。
33.(7分)同学们在探究碱溶液与酚酞溶液作用的实验时,发现了一个意外现象:向氢氧化钠溶液中滴入酚酞溶液(如图),溶液变成了红色,但是一会儿红色就消失了。为此某化学小组的同学进行了如下探究。
[提出猜想]甲:可能是酚酞溶液变质的缘故
乙:可能是氢氧化钠溶液与空气中二氧化碳反应的缘故
丙:可能是氢氧化钠与酚酞混合后与空气中氧气反应,使红色消失的缘故
丁:可能与氢氧化钠溶液的质量分数有关
[查阅资料]酚酞是一种常用酸碱指示剂,遇碱性溶液变红。
[讨论分析]
(1)甲同学提出猜想后,很快被小组同学否定了,其理由是 。
(2)经过思考,大家认为乙同学的猜想也不正确,其理由是 。
[实验设计]
(3)为验证丙同学的猜想是否正确,小组同学做了如下实验,请完成表中内容。
|
实验步骤 |
实验目的 |
现象结论 |
|
①用煮沸过的蒸馏水配制某氢氧化钠溶液。 |
。 |
溶液先变成红色,一会儿红色又消失。 丙同学的猜想不正确。 |
|
②取少量上述氢氧化钠溶液,滴入酚酞,然后在上方滴一些植物油。 |
。 |
(4)为验证丁同学的猜想是否正确,小组同学进行了如下实验探究,请回答有关问题。
|
实验方法 |
观察到的现象和结论 |
|
方案一:分别配制不同质量分数的氢氧化钠溶液,然后各取少量并滴加2滴酚酞溶液。 |
质量分数小的溶液中红色不消失,质量分数大的溶液中红色会消失,则证明 。 |
|
方案二: 。 |
出现红色且不褪去,结论同上。 |
[知识拓展]
⑸若将质量分数为10%和20%的氢氧化钠溶液等质量混合,所得溶液中溶质的质量分数是 。
A.10% B.15% C.20% D.30%
33.活动Ⅰ:NaHCO3 + HCl = NaCl + H2O + CO2↑ 浓硫酸
2NaOH + CO2 = Na2CO3 + H2O 将带火星的木条伸入集气瓶中
活动Ⅱ:质量守恒定律(或二氧化碳与超氧化钾都不含氢元素,根据质量守恒定律,不可能生成含有氢元素的酸或碱)
(2分)2CO2 + 4KO2 == 2K2CO3 + 3O2
若超氧化钾有剩余,加入盐酸后会产生氧气,也能观察到有气泡产生,不能证明样品中含有碳酸盐。
(2分,答出剩余的超氧化钾能跟水反应产生氧气可得分)
(东城)
32.方案一:b
方案二: ①氢氧化钠固体溶于水放热使气体体积膨胀
②稀盐酸进入烧瓶占据了一定体积
方案三:
(1)防止氢氧化钠溶液中溶有氧气
(2)取少量原氢氧化钠溶液于试管中,加入适量水稀释,滴入无色酚酞试液,一段时间后,若红色不消失,则证明红色消
失是氢氧化钠溶质的质量分数过大所致。
(2分,答案不全面不得分)
33. (9分)小波在“化学氧自救器”的说明书中看到“人呼出的二氧化碳与自救器药罐中的生氧剂(超氧化钾
(9分)小波在“化学氧自救器”的说明书中看到“人呼出的二氧化碳与自救器药罐中的生氧剂(超氧化钾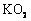 )接触能产生氧气”,对自救器内发生化学反应原理产生了探究欲望。他与同学们一起进行了实验探究活动。
)接触能产生氧气”,对自救器内发生化学反应原理产生了探究欲望。他与同学们一起进行了实验探究活动。
活动Ⅰ:探究 与超氧化钾(
与超氧化钾(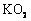 )反应确实可以生成
)反应确实可以生成 。
。
[查阅资料]超氧化钾(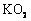 )能与
)能与 、
、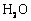 反应生成
反应生成 ;
;
未查到超氧化钾(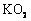 )能否与HCl气体反应的资料。
)能否与HCl气体反应的资料。
[进行实验]同学们设计了如下实验装置。其中A装置的作用是除去 中混入的
中混入的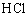 气体,该反应的化学方程式是________。B装置中盛放的液体药品是_____。D装置的作用是___(用化学方程式表示)。为了得出结论,最后还要进行的实验操作是______。
气体,该反应的化学方程式是________。B装置中盛放的液体药品是_____。D装置的作用是___(用化学方程式表示)。为了得出结论,最后还要进行的实验操作是______。
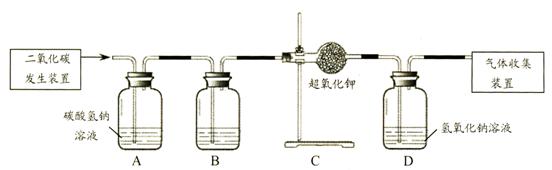
活动Ⅱ:探究二氧化碳与超氧化钾反应除生成氧气外还生成什么物质?
[老师提示]二氧化碳与超氧化钾反应的产物只有氧气和某化合物。
[做出猜想]二氧化碳与超氧化钾反应生成的化合物是什么?小波同学做出了三种猜想:①是一种酸;②是一种碱;③是一种碳酸盐。
通过分析,小英同学认为猜想①和②是错误的,她得出此结论的依据是__________。
[进行实验]验证猜想③是正确的。
|
实验步骤 |
实验现象 |
实验结论 |
|
取适量二氧化碳与超氧化钾反应后的固体于试管中,滴另适量稀盐酸,并将产生的气体通入澄清石灰水中。 |
固体逐渐消失,有无色气泡产生,澄清石灰水变浑浊。 |
猜想③是正确的。 |
[反思评价]二氧化碳与超氧化钾反应的化学方程式是_______。滴加稀盐酸后,若不将产生的气体通入澄清石灰水,就不能验证猜想③是正确的,其理由是_______。
32.(西城)(6分)有的化学反应伴随明显现象,有的化学反应则没有明显现象。某兴趣小组同学为证明NaOH与稀盐酸能发生化学反应,从不同角度设计了如下方案,并进行实验。
方案一:先用pH试纸测定NaOH溶液的pH,再滴加盐酸并不断振荡,同时测定溶液的pH,若测得溶液的pH____(填序号),则证明NaOH与稀盐酸发生了化学反应。
a.逐渐增大并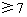 b.逐渐减小并
b.逐渐减小并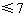 c.始终不变并等于7
c.始终不变并等于7
方案二:化学反应通常伴随能量的变化,可借助反应前后的温度变化来判断是否发生了反应。某同学在不使用温度计的情况下,通过右图所示装置进行实验,观察到红墨水向右移动。有的同学提出,该现象不足以证明NaOH与稀盐酸发生了化学反应,他的理由是:①_________;②________。
方案三:向NaOH溶液中滴加酚酞试液,溶液显红色,再滴加稀盐酸,若红色消失,则证明NaOH与稀盐酸发生了化学反应。实验中,同学们发现了一个意外现象:
向NaOH溶液中滴入酚酞试液,溶液变红,片刻,红色消失。同学们对此进行了探究。
|
猜想 |
实验操作 |
实验现象 |
结论与解释 |
①可能是红色溶液与空气中的 发生了反应,使红色消失 发生了反应,使红色消失 |
用煮沸过的蒸馏水配制上述NaOH溶液,在液面上方滴些植物油,冷却后加入酚酞试液。 |
溶液变成红色,片刻,红色消失。 |
红色消失的现象与空气中的 无关。 无关。 |
②可能是NaOH溶液与空气中 反应生成了 反应生成了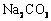 ,使红色消失。 ,使红色消失。 |
取少量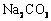 溶液,向其中滴入酚酞试液。 溶液,向其中滴入酚酞试液。 |
溶液变红色,一段时间后,红色不消失。 |
红色消失的现象与空气中的 无关。 无关。 |
(1)在验证猜想①的实验中“煮沸”和“滴入植物油”的目的是_________。
(2)该小组同学通过查阅资料得知:当选用溶质的质量分数大于10%的氢氧化钠溶液时,就会出现上述意外现象。请你设计实验证明:上述方案中红色消失是NaOH溶液中溶质的质量分数过大所致。你的实验方案是______。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com