
33.(6分)化学实验室有ABCDEF六瓶无色透明溶液,它们分别是碳酸钠、氢氧化钠、氢氧化钙、氯化钠、酚酞、盐酸中的一种。为了区别它们,化学小组同学分别进行下列实验(实验步骤略去):






A B C D E F
Ⅰ.将B分别滴入ACDEF中,A有气泡产生,E显红色,C产生白色沉淀,其余均无明显现象。
Ⅱ.将E分别滴入ABCDF中, BCD均显红色,
根据上述实验现象,完成下列填空:
(1)写出下列物质的化学式或名称:
B ,D ,E , F 。
(2)写出A与 C反应的化学方程式 ,
(3)当E滴入B中显红色后,再将A逐滴滴入混合液中,充分反应后的实验现象是
。
(4)假设所取六种无色溶液相互反应后的所得溶液的pH<7,则溶液中的溶质可能是
。
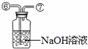
32.(朝阳区)(7分)某校化学兴趣小组的同学对敞口放置的固体烧碱的变质程度开展了探究。
写出烧碱发生变质反应的化学方程式______________________________________。
为确定固体混合物中碳酸钠的质量分数,他们设计了如下几种不同的实验方案:
[方案一] 气体分析法。

(1)若用图甲中的收集装置,则所测CO2气体的体积________(填“偏大”、“偏小”、“不变”),理由是 ,你的改进措施是 。
(2)若用乙装置测定CO2的质量(碱石灰是CaO和NaOH的混合物)。该实验设计中的缺陷是 (答一点即可)。
[方案二]沉淀分析法。
资料:部分碱和盐的溶解性表(20℃)
|
|
OH– |
Cl- |
CO32-
|
SO42- |
|
Ca2+ |
微 |
溶 |
不 |
微 |
|
Mg2+ |
不 |
溶 |
不 |
溶 |
|
Fe3+ |
不 |
溶 |
- |
溶 |
|
Cu2+ |
不 |
溶 |
不 |
溶 |

发生反应的化学方程式是 ,溶液M中的溶质是 。
96.(3)偏高
(4)4%
(5)Na2CO3 + CaCl2 CaCO3↓+ 2NaCl(或与BaCl2、Ba(OH)2反应)
33.(6分)
(1)Na2CO3 + H2SO4 Na2SO4 + H2O + CO2↑。
(2)排出装置A及导管中残留CO2,使其全部被装置B中NaOH溶液吸收;
检验CO2是否被B瓶中的NaOH溶液完全吸收
32.(7分)
(1)C B A
(2)B D
(3)D E G
(4)26.32 g, ①, ② ③ ⑤
(5)A
31.(5分)
 (1)酒精灯;
(1)酒精灯;
(2)O2 2KMnO4 K2MnO4+MnO2+O2↑ D(或E等)
 (3)②→⑩→
→⑨→⑧→⑥
(3)②→⑩→
→⑨→⑧→⑥
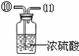
33. (6分)某同学在查阅资料时得知:市售纯碱样品常混有氯化钠杂质。
(6分)某同学在查阅资料时得知:市售纯碱样品常混有氯化钠杂质。
|

该同学设计了如下图中的装置进行实验,测定市售纯碱样品中碳酸钠的质量分数。(水蒸气的影响忽略不计,夹持装置已略去)
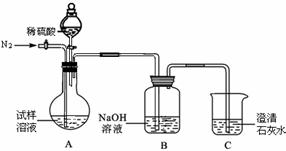
主要实验步骤如下:
①按图组装仪器,并检查装置的气密性;
②称量5.5 g市售纯碱样品放入烧瓶中,加适量蒸馏水溶解,得到试样溶液;
③从分液漏斗滴入稀硫酸,直到不再产生气体时为止;
④缓缓鼓入一定量的N2;
⑤称量B瓶及溶液的质量,发现增重2.2 g。
请回答下列问题:
(1)写出A中发生反应的化学方程式 。
(2)鼓入一定量的N2的目的是 。装置C中澄清石灰水的作用是 。
(3)如果将分液漏斗中的稀硫酸换成浓盐酸,测试的结果(填偏高、偏低或不变) 。
(4)该样品中碳酸钠的质量分数为 %(结果保留到小数点后一位)。
(5)若用与上述实验反应原理不同的实验来测定纯碱样品中碳酸钠的质量分数,请用化学方程式表示实验原理 。
32. (7分)某兴趣小组做了如下实验。
(7分)某兴趣小组做了如下实验。
[实验一]提纯NaCl
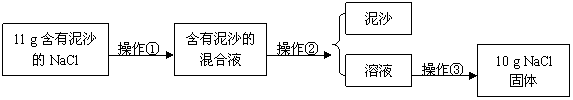

请根据实验回答下列问题:
(1)操作①、②、③依次为下图中的(填序号) 。
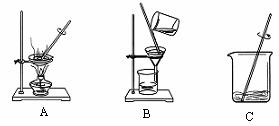
(2)若得到NaCl的产率比实际值偏低,则可能的原因是(填序号) 。
A.过滤时滤纸有破损
B.蒸发时有固体溅出
C.蒸发时,看到晶体析出,立即停止加热
D.溶解11 g含有泥沙的NaCl时,加入的水量不足
(3)用上述实验所得的氯化钠配制5%的氯化钠溶液50 g,不需要的仪器为(填序号) 。
A.量筒 B.天平 C.烧杯 D.漏斗 E.蒸发皿 F.玻璃棒 G.酒精灯
[实验二]溶解和结晶KNO3
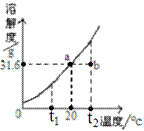 请根据实验和溶解度曲线回答下列问题(水的密度以1 g/mL计):
请根据实验和溶解度曲线回答下列问题(水的密度以1 g/mL计):
|
实验操作 |
实验结果 |
|
取20
mL水,加入5 g KNO3,搅拌,恢复至20℃ |
全部溶解,得溶液① |
|
再加X
g KNO3,搅拌 |
恰好饱和,得溶液② |
|
再加5
g KNO3,搅拌 |
得溶液 ③ |
|
加热 |
全部溶解,得溶液④ |
|
冷却至20℃ |
晶体析出,母液⑤ |
(4)③中溶液的质量为 ;一定属于不饱和溶液的是(填数字序号) ;
溶质的质量分数一定相等的是(填序号) 。
(5)析出晶体的质量为(填序号) 。
A.5 g B.X+5 g C.X+10 g
31.(5分)现有下列实验装置示意图:

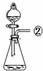
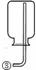

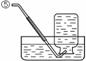

A B C D E F G H
请回答下列问题:
(1)A装置中a仪器的名称是 。
(2)选用A装置可以制备的一种气体是 ,制取该气体的化学反应方程式是 ,收集该气
体可选用的装置为(请填序号,答出一种即可) 。
(3)现有如下资料:
① 制取NO2的反应原理:Cu+4HNO3(浓) = Cu(NO3)2+2NO2↑ +2H2O
② 通常状况下,NO2是一种密度比空气大的有毒气体,能与水发生反应。
③ NO2能与碱溶液反应生成盐和水。
若在实验室中用上述装置制备并收集一瓶干燥的二氧化氮气体,则所选装置从左到右的连接顺序为(填接口序号) 。
33. (实验猜想和⑵为2分,其余每空1分,共6分)
[实验猜想]可能铝粉过量,铁和过量的铝在900-1550℃时会熔化,此时熔融物会含有铁和铝。
[实验验证]
⑴
|
步骤 |
现象 |
结论 |
|
加入过量(或适量)的稀硫酸(或稀盐酸)溶液 |
溶液由无色变成浅绿色 |
|
⑵ 若4.6克全部为铁时,产生氢气的质量会小于(4.6-4.4)g,所以熔融物还要含有铝;
(海淀)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com