
25.(15分)
我国规定:室内甲醛含量不得超过0.0 8mg·m-3。某研究性学习小组欲利用酸性KMnO4溶液测定空气中甲醛(HCHO)的含量。 [查阅资料]KMnO4 ( H+)溶液为强氧化剂,可氧化甲醛和草酸。 4MnO4―+5HCHO+H+=4Mn2++5CO2↑+11H2O 2MnO4―+5H2C2O4+6H+=2Mn2++10CO2 ↑+8H2O [实验一]K^S*5U.C
按如图所示装置进行采样
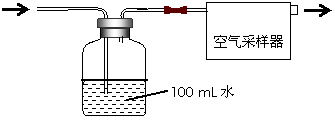
(1)由图可知甲醛的物理性质为
(2)空气中甲醛采样吸收装置中用到的玻璃仪器为:玻璃导管、
(3)为了使通过吸收装置的甲醛尽可能被吸收液吸收,可采取的措施是:(只写出一种即可) 。
设置空气采集器为恒定流量0.5 L/min,采集20min。K^S*5U.C
[实验二]
量取10.00 mL 的甲醛吸收液转移到锥形瓶中,量取12.00 mL 1.00×10-3 mol·L-1 KMnO4溶液于锥形瓶中,并滴入几滴稀H2SO4备用
(4)用1.00×10-3 mol·L-1标准草酸溶液进行滴定,当
时,达到滴定终点。
(5)记录滴定所消耗的草酸溶液的体积。重复实验2次,消耗草酸溶液的体积分别为10.90 mL、10.02 mL、9.98 mL。计算该居室内空气中甲醛的浓度为 mg·m-3。
(6)若滴定过程中,发现滴定管下端开始有气泡,滴定后气泡消失,则测定结果将
(填“偏大”、“无影响”、“偏小”)
[实验三]K^S*5U.C
环境监测站工作人员采样后,将5.00 mL 的甲醛吸收液注入比色瓶中,再向比色瓶中注入显色试剂0.5 mL,盖紧瓶塞,摇匀,静置显色。当室内环境温度不同时,记录显色时间见下表。
|
环境温度/℃ |
5 |
10 |
15 |
20 |
25 |
30 |
35 |
|
显色时间/min |
45 |
30 |
15 |
13 |
10 |
7 |
5 |
(7)由该表可以得出的结论是
(8)请用化学反应原理解释
24. (16分)应用化学反应需要研究化学反应的条件、限度和速率。
(1) 已知反应:Br2+2Fe2+=2Br-+2Fe3+ ,向10 mL 0.1 mol·L-1的FeBr2溶液中通入0.001 mol Cl2,反应后,溶液中除含有Cl-外,还一定有 (填序号)。
① 含Fe2+,不含Fe3+② 含Fe3+,不含Br-③ 含Fe3+,还含有Br-
(2) 773 K、固定体积的容器中,反应CO(g)+2H2(g) CH3OH(g)过程中能量变化如下图。曲线Ⅱ表示使用催化剂时的能量变化。若投入a mol CO、2a mol H2,平衡时能生成0.1a mol CH3OH,反应就具工业应用价值
CH3OH(g)过程中能量变化如下图。曲线Ⅱ表示使用催化剂时的能量变化。若投入a mol CO、2a mol H2,平衡时能生成0.1a mol CH3OH,反应就具工业应用价值
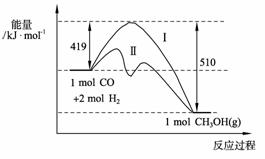
① 若按上述投料比使该反应具有工业应用价值,CO的平衡转化率最小为 ;
② 在容器容积不变的前提下,欲提高H2的转化率,可采取的措施(答两项即可) 、 ;
③ 下列与催化剂有关的说法中,正确的是 (填字母序号)。
a. 使用催化剂,使反应CO(g)+2H2(g) CH3OH(g) ΔH>-91
kJ·mol-1
CH3OH(g) ΔH>-91
kJ·mol-1
 b. 使用催化剂, 能够提高反应物转化率
b. 使用催化剂, 能够提高反应物转化率
c. 使用催化剂,不能改变反应的平衡常数K
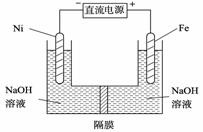
(3) 高铁酸盐在能源环保领域有广泛用途。我国学者提出用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的方案,装置如右图所示
① Ni作 (填“阴”或“阳”) 极;
②Ni电极的电极反应式为: 。
(4) 氧化还原反应中实际上包含氧化和还原两个过程。下面是HNO3发生的一个还原过程的反应式:NO-3+4H++3e-→NO+2H2O
① KMnO4、HCl、Fe(NO3)2、CuO、KI五种物质中的 (填化学式)能使上述还原过程发生。
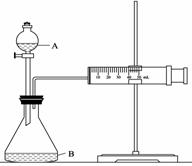
② 欲用下图装置通过测定气体生成量测算硝酸被还原的速率,当反应物的浓度、用量及其他影响速率的条件确定之后,可以通过测定 推(计)算反应速率。
23.(15分)A、B、C、D、E、F是原子半径依次减小的短周期元素,A、C两元素形成的化合物是厨房中最常用的调味品, A、B、C的最高价氧化物对应的水化物两两间均能反应生成盐和水;D元素的同位素之一被用来作为相对原子质量和阿伏加德罗常数的标准;E元素能形成多种同素异形体,其中一种是导致许多食品、药品变质的气体;F元素的氧化物是许多有机物燃烧的液态生成物。据此回答: (1)A、C、E按原子个数之比1 :1 :1形成的化合物是一种常见的消毒剂,将该消毒剂的水溶液滴在pH试纸上,可观察到现象是 ,原因是 。
(2)我国首创的海洋电池以B的单质为负极,铂网为正极,空气做氧化剂,海水做电解质溶液。电池的正极反应式为 ,电池总反应的化学方程式为 。
(3)C的最高价氧化物为无色液体,0.25 mol 该物质与一定量水混合得到一种稀溶液,并放出Q kJ 的热量。写出该反应的热化学方程式: ____________________________________。
(4)在1 L的密闭容器中,充入1 mo1DE和1 mo1 F2E
(g),于850℃时进行化学反应:DE (g) + F2E (g) DE2(g) + F2(g) △H<0,达平衡时,有50%的DE转化为DE2。在相同温度下,将1 mo1DE和4 mo1 F2E
(g)充入同样的容器中,记录0~8分钟内测得容器内各物质的物质的量如下表。t分钟时为改变条件后达平衡时所测得的数据。下列说法正确的是K^S*5U.C
DE2(g) + F2(g) △H<0,达平衡时,有50%的DE转化为DE2。在相同温度下,将1 mo1DE和4 mo1 F2E
(g)充入同样的容器中,记录0~8分钟内测得容器内各物质的物质的量如下表。t分钟时为改变条件后达平衡时所测得的数据。下列说法正确的是K^S*5U.C
|
时间/min |
n(DE)/ mo1 |
n(F2E)/mo1 |
n(DE2)/ mo1 |
n(F2)/ mo1 |
|
0 |
1 |
4 |
0 |
0 |
|
4 |
0.25 |
3.25 |
0.75 |
0.75 |
|
6 |
n1 |
n2 |
n3 |
n4 |
|
8 |
n1 |
n2 |
n3 |
n4 |
|
t |
0.15 |
3.15 |
0.85 |
0.85 |
①反应在第4 min时,v(正) v(逆)(填“>”、“=”或“<”)。
②8分钟时,混合气体中DE2的体积分数为 。
③t分钟时,反应所处的温度 850℃(填“>”、“=”或“<”)。
22.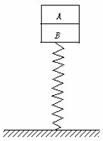 (20分)A、B两木块叠放在竖直轻弹簧上,如图所示,已知木块A、B质量分别为0.42 kg和0.40 kg,弹簧的劲度系数k=100 N/m ,若在木块A上作用一个竖直向上的力F,使A由静止开始以0.5 m/s2的加速度竖直向上做匀加速运动(g=10 m/s2).
(20分)A、B两木块叠放在竖直轻弹簧上,如图所示,已知木块A、B质量分别为0.42 kg和0.40 kg,弹簧的劲度系数k=100 N/m ,若在木块A上作用一个竖直向上的力F,使A由静止开始以0.5 m/s2的加速度竖直向上做匀加速运动(g=10 m/s2).
(1)使木块A竖直做匀加速运动的过程中,力F的最大值;¥高#考#资%源*网
(2)若木块由静止开始做匀加速运动,直到A、B分离的过
程中,弹簧的弹性势能减少了0.248 J,求这一过程F对木块做的功.
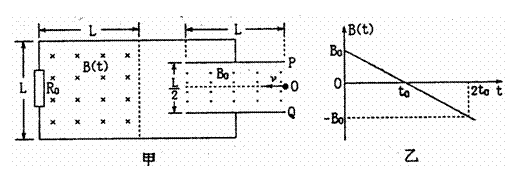
21.(19分)如图甲所示,长度为L的金属板P、Q水平放置,两板间的距离为L/2,用直导线将P、Q金属板与电阻R0相连,上、下两水平直导线间的距离为L,在距左端为L的域有均匀分布但随时间按图乙所示规律变化的磁场B(t)(零时刻磁感应强度大小为B0,并规定方向垂直纸面向里为正方向),在P、Q金属板间有磁感应强度大小为B0、方向垂直纸面向外的匀强磁场,重力加速度为g。K^S*5U.C
(1)一带负电小球,带电荷量为q,从P、Q金属板的右端中央O点以速度v水平射入两板间,若带电小球的质量m= ,试分析说明小球在P、Q金属板间将怎样运动。
,试分析说明小球在P、Q金属板间将怎样运动。
(2)对第(1)问所述的情况,要使带电小球能从P、Q金属板间左侧射出,速度v应满足什么条件?
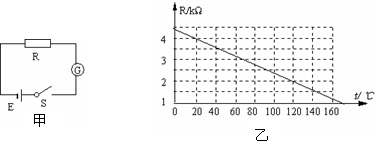
20.(15分)温度传感器广泛应用于室内空调、电冰箱和微波炉等家用电器中,它是利用热敏电阻的阻值随温度变化而变化的特性工作的.在图(甲)中,电源的电动势E=9.0V,内电阻可忽略不计;G为灵敏电流表,内阻Rg保持不变;R为热敏电阻,其电阻值R随温度t变化关系如图(乙)的R-t图线所示.闭合开关S,当R的温度等于20℃时,电流表的示数I1=2mA,问当电流表的示数I2=3.6mA时,热敏电阻R的温度是多少摄氏度?
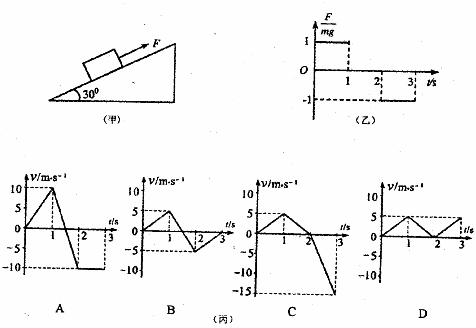
18.图甲所示,在倾角为30°足够长的光滑斜面上,质量为m的物块受到平行于斜面的力F作用,其变化规律如图乙,纵坐标为F与mg的比值,规定力沿斜面向上为正方向,则丙中正确表达物块速度v随时间t变化规律的是(物块初速度为零,g取10m/s ):
):
第Ⅱ卷 必考部分
 共9题,共157分
共9题,共157分
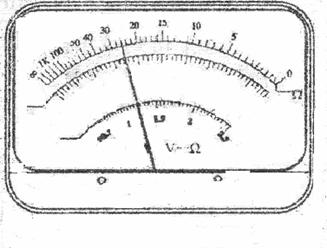
①某同学用多用电表的欧姆挡测量电阻RX的阻值,当选择开关置于欧姆挡“×100”的位置时,多用电表指针示数如图1所示,此被测电阻的阻值约为 Ω.
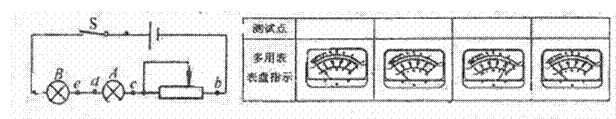
②某同学按如图2所示的电路图连接元件后,闭合开关S,发现A、B灯都不亮。该同学用多用电表的欧姆挡检查电路的故障。检查前,应将开关S 。(选填“闭合”或“断开”) K^S*5U.C
③若②中同学检查结果如下图所示,由此可以确定( )
A.灯A断路 B.滑动变阻器断路
C.灯A、B都断路 D.d、e间导线断路
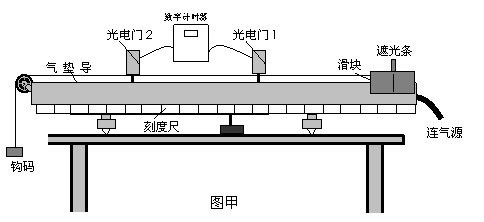 (2)(10分)某实验小组利用如图甲所示的实验装置来探究当合外力一定时,物体运动的加速度与其质量之间的关系。
(2)(10分)某实验小组利用如图甲所示的实验装置来探究当合外力一定时,物体运动的加速度与其质量之间的关系。
①由图甲中刻度尺读出两个光电门中心之间的距离s=24cm,由图乙中游标卡尺测得遮光条的宽度d= cm。该实验小组在做实验时,将滑块从图甲所示位置由静止释放,由数字计时器可以读出遮光条通过光电门1的时间Δt1,遮光条通过光电门2的时间Δt2,则滑块经过光电门1时的瞬时速度的表达式v1= ,滑块经过光电门2时
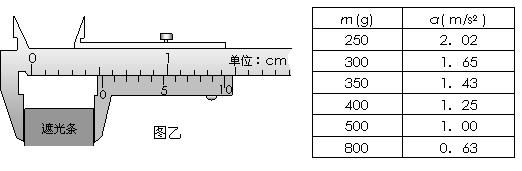
的瞬时速度的表达式v2 = ,则滑块的加速度的表达式a= 。(以上表达式均用字母表示)。
②在本次实验中,实验小组通过改变滑块质量总共做了6组实验,得到如下表所示的实验数据。通过计算分析上表数据后,你得出的结论是 ,
③如果想通过图像法进一步确认自己的结论,简要说出你的做法
17.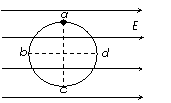 如图,绝缘光滑的圆环竖直放置在水平向右的匀强电场中,环上a、c是竖直直径的两端,b、d是水平直径的两端,质量为m的带电小球套在圆环上,从a点由静止释放,沿abc运动到d点时的速度恰好为零。在沿a→b→c→d的过程中,则小球:
如图,绝缘光滑的圆环竖直放置在水平向右的匀强电场中,环上a、c是竖直直径的两端,b、d是水平直径的两端,质量为m的带电小球套在圆环上,从a点由静止释放,沿abc运动到d点时的速度恰好为零。在沿a→b→c→d的过程中,则小球:
A.在d点的加速度为零 B.在b点的向心加速度最大
C.在d点的电势能最小 D. 在b点的机械能最大
16.2010年1月17日,我国在西昌卫星发射中心用“长征三号丙”运载火箭,成功将第三颗北斗导航卫星送入预定轨道,这标志着北斗导航卫星系统工程建设又迈出重要一步。我国自主研制的“北斗一号”卫星导航系统在四川汶川抗震救灾和北京奥运会中发挥了巨大的作用。北斗导航系统又被称为“双星定位系统”,具有导航、定位等功能。“北斗”系统中两颗工作星均绕地心O做匀速圆周运动,轨道半径为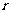 ,某时刻2颗工作卫星分别位于轨道上的A、B两位置(如图所示).若卫星均顺时针运行,地球表面处的重力加速度为g,地球半径为R,不计卫星间的相互作用力.则以下判断中错误的是:
,某时刻2颗工作卫星分别位于轨道上的A、B两位置(如图所示).若卫星均顺时针运行,地球表面处的重力加速度为g,地球半径为R,不计卫星间的相互作用力.则以下判断中错误的是:
A.这2颗卫星的加速度大小相等,均为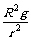
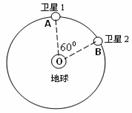 B.卫星1向后喷气就一定能追上卫星2
B.卫星1向后喷气就一定能追上卫星2
C.卫星1由位置A运动到位置B所需的时间为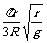
D.卫星1由位置A运动到位置B的过程中万有引力做功为零
15.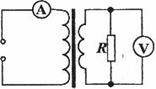 如图所示,理想变压器原副线圈匝数之比为4:1。原线圈接入一电压为
如图所示,理想变压器原副线圈匝数之比为4:1。原线圈接入一电压为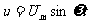 的交流电源,副线圈接一个R=27.5
的交流电源,副线圈接一个R=27.5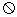 的负载电阻。若
的负载电阻。若 ,则下述结论正确的是:
,则下述结论正确的是:
A.副线圈中电压表的读数为880V
B.副线圈中输出交流电的周期为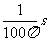
C.原线圈中电流表的读数为0.5 A
D.原线圈中的输入功率为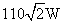
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com