
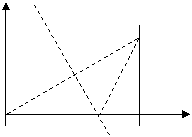
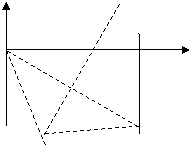
26.(全国卷1)(21分)如下图,在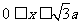 区域内存在与xy平面垂直的匀强磁场,磁感应强度的大小为B.在t=0时刻,一位于坐标原点的粒子源在xy平面内发射出大量同种带电粒子,所有粒子的初速度大小相同,方向与y轴正方向的夹角分布在0-180°范围内。已知沿y轴正方向发射的粒子在
区域内存在与xy平面垂直的匀强磁场,磁感应强度的大小为B.在t=0时刻,一位于坐标原点的粒子源在xy平面内发射出大量同种带电粒子,所有粒子的初速度大小相同,方向与y轴正方向的夹角分布在0-180°范围内。已知沿y轴正方向发射的粒子在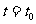 时刻刚好从磁场边界上
时刻刚好从磁场边界上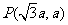 点离开磁场。求:
点离开磁场。求:
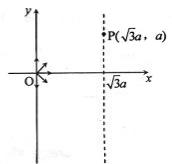
⑴ 粒子在磁场中做圆周运动的半径R及粒子的比荷q/m;
⑵ 此时刻仍在磁场中的粒子的初速度方向与y轴正方向夹角的取值范围;
⑶ 从粒子发射到全部粒子离开磁场所用的时间。
[答案]⑴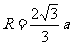
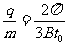
⑵速度与y轴的正方向的夹角范围是60°到120°
⑶从粒子发射到全部离开所用
时间
为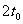
[解析] ⑴粒子沿y轴的正方向进入磁场,从P点经过做OP的垂直平分线与x轴的交点为圆心,根据直角三角形有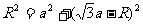
解得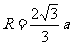
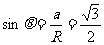 ,则粒子做圆周运动的的圆心角为120°,周期为
,则粒子做圆周运动的的圆心角为120°,周期为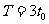
粒子做圆周运动的向心力由洛仑兹力提供,根据牛顿第二定律得
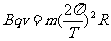 ,
,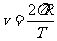 ,化简得
,化简得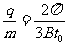
⑵仍在磁场中的粒子其圆心角一定大于120°,这样粒子角度最小时从磁场右边界穿出;角度最大时从磁场左边界穿出。
角度最小时从磁场右边界穿出圆心角120°,所经过圆弧的弦与⑴中相等穿出点如图,根据弦与半径、x轴的夹角都是30°,所以此时速度与y轴的正方向的夹角是60°。
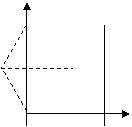 角度最大时从磁场左边界穿出,半径与y轴的的夹角是60°,则此时速度与y轴的正方向的夹角是120°。
角度最大时从磁场左边界穿出,半径与y轴的的夹角是60°,则此时速度与y轴的正方向的夹角是120°。
所以速度与y轴的正方向的夹角范围是60°到120°
⑶在磁场中运动时间最长的粒子的轨迹应该与磁场的右边界相切,在三角形中两个相等的腰为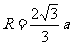 ,而它的高是
,而它的高是
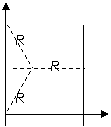
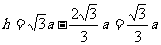 ,半径与y轴的的夹角是30°,这种粒子的圆心角是240°。所用
时间
为
,半径与y轴的的夹角是30°,这种粒子的圆心角是240°。所用
时间
为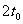 。
。
所以从粒子发射到全部离开所用 时间 为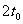 。
。
(全国卷2)26(21分)图中左边有一对平行金属板,两板相距为d,电压为V;两板之间有匀强磁场,磁场应强度大小为B0,方向平行于板面并垂直于纸面朝里。图中右边有一边长为a的正三角形区域EFG(EF边与金属板垂直),在此区域内及其边界上也有匀强磁场,磁感应强度大小为B,方向垂直于纸面朝里。假设一系列电荷量为q的正离子沿平行于金属板面,垂直于磁场的方向射入金属板之间,沿同一方向射出金属板之间的区域,并经EF边中点H射入磁场区域。不计重力
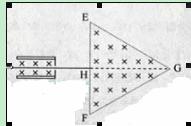
(1)已知这些离子中的离子甲到达磁场边界EG后,从边界EF穿出磁场,求离子甲的质量。
(2)已知这些离子中的离子乙从EG边上的I点(图中未画出)穿出磁场,且GI长为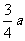 ,求离子乙的质量。
,求离子乙的质量。
(3)若这些离子中的最轻离子的质量等于离子甲质量的一半,而离子乙的质量是最大的,问磁场边界上什么区域内可能有离子到达。
解析:
(1)在粒子进入正交的电磁场做匀速直线运动,设粒子的速度为v,电场的场强为E0,根据平衡条件得
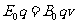 ①
①
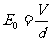 ②
②
由①②化简得
 ③
③
粒子甲垂直边界EF进入磁场,又垂直边界EF穿出磁场,则轨迹圆心在EF上。粒子运动中经过EG,说明圆轨迹与EG相切,在如图的三角形中半径为

R=acos30°tan15° ④
tan15°=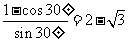 ⑤
⑤
联立④⑤化简得
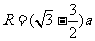 ⑥
⑥
在磁场中粒子所需向心力由洛伦磁力提供,根据牛顿第二定律得
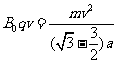 ⑦
⑦
联立③⑦化简得
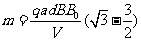 ⑧
⑧
(2)由于1点将EG边按1比3等分,根据三角形的性质说明此轨迹的弦与EG垂直,在如图的三角形中,有
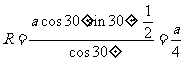 ⑨
⑨
同理
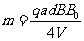 (10)
(10)
(3)最轻离子的质量是甲的一半,根据半径公式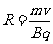 离子的轨迹半径与离子质量呈正比,所以质量在甲和最轻离子之间的所有离子都垂直边界EF穿出磁场,甲最远离H的距离为
离子的轨迹半径与离子质量呈正比,所以质量在甲和最轻离子之间的所有离子都垂直边界EF穿出磁场,甲最远离H的距离为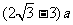 ,最轻离子最近离H的距离为
,最轻离子最近离H的距离为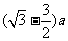 ,所以在离H的距离为
,所以在离H的距离为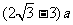 到
到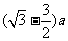 之间的EF边界上有离子穿出磁场。
之间的EF边界上有离子穿出磁场。
比甲质量大的离子都从EG穿出磁场,期中甲运动中经过EG上的点最近,质量最大的乙穿出磁场的1位置是最远点,所以在EG上穿出磁场的粒子都在这两点之间。
28. 有机物A、B均稳定,且分子式相同。取0.1mol A完全燃烧,得二氧化碳26.4g。A、B分别跟足量的乙酸并在浓硫酸存在条件下反应,生成C、D两种有机物,C的相对分子质量比D的相对分子质量大42。B、E以任意质量比混合,只要总质量不变,完全燃烧后耗氧气量和生成的水量都不变。0.1mol E能与足量银氨溶液反应生成43.2g银,且E的相对分子质量小于58。B能与新制氢氧化铜的悬浊液反应生成红色沉淀。A的任意一个羟基被溴原子取代所得的一溴代物都只有一种。
(1)通过计算和推理,确定A、B、E各物质的结构简式分别为:
A ;B ;E ;
(2)写出B→D的化学反应方程式(有机物写结构简式)。
。
(3)在120℃时,由A、B、E组成的混合物wg与氧气充分反应,生成产物全部为气体时,消耗氧气[m (O2)]的质量范围为________________________。
(4)B与乙酸在一定条件下反应的有机产物中分子量在221至265之间的有机产物总共有 种。A与乙酸在一定条件下反应的有机产物中分子量在300至350之间的有机产物总共有 种。
27. 四川盛产柠檬,这种果实中富含柠檬酸。柠檬酸有温和爽快的酸味,多用于各种饮料的生产原料,在有机酸的市场中占有率为70%以上。
(1)已知柠檬酸仅由C、H、O三种元素组成。其分子量不超过200,其中含氧元素58.3%。通过计算并写出柠檬酸的分子式_______________。
(2)已知柠檬酸不能被CuO氧化,与氯气反应后的一氯代物只有一种,1 mol 的柠檬酸分别与钠和碳酸氢钠反应生成气体为2 mol 和3 mol,则柠檬酸的结构式为: 。
(3)柠檬酸和乙醇与浓硫酸共热能发生酯化反应,可生成 种酯类化合物。
(4)柠檬酸可以烃A为主要原料加以合成。已知:
i.烃中既有双键又有叁键时,一定条件下叁键先发生反应;
ii.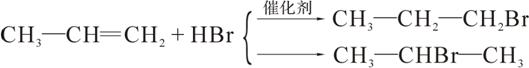
烃A合成柠檬酸的一种合成途径如下,其中1molC与2molHBr反应生成D,D中只含3种不同的氢原子:根据以上信息回答下列问题:
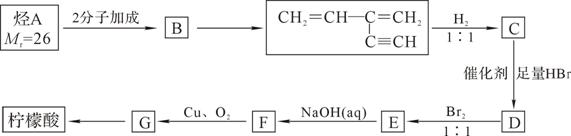
①G中含氧官能团的名称为 ;E→F的反应类型为___ _____;
②B的结构简式为______________________;C与足量H2反应生成一种烷烃H,用系统命名法命名H的名称为 ;
③写出指定反应的化学方程式:
G+新制Cu(OH)2: ;
F→G:________ ___ ______ 。
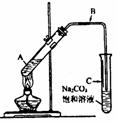
26.(12分)某课外小组利用乙炔与酸性KMnO4溶液反应,测定乙炔的相对分子质量。下图是测定装置示意图。
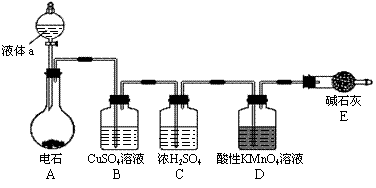

⑴实验室制取乙炔时,分液漏斗中的液体a通常是_________________。
⑵CuSO4溶液的作用是_________________________________。
⑶配平乙炔与酸性KMnO4溶液反应的化学方程式(请在方框中填计量系数):
□C2H2+□KMnO4+□H2SO4-□K2SO4+□MnSO4+□CO2↑+□H2O
⑷该小组实验如下:实验前,D装置中KMnO4的物质的量为x mol。实验完毕,D及E装置的总质量共增重y g,此时D中过量的KMnO4恰好能与含z mol FeSO4的溶液完全反应(注:反应中MnO4- 被还原成Mn2+,Fe2+被氧化成Fe3+)。则所测乙炔的相对分子质量是(请用含字母x、y、z的代数式表示)_____________。
⑸若该小组实验原理及所有操作均正确,则下列各因素对所测乙炔的相对分子质量没有影响的是(填选项)__________。
A.装置A中产生的气体直接通入酸性KMnO4溶液
B.乙炔通过酸性KMnO4溶液的速率过快,少量乙炔未被氧化而逸出
C.将E装置(盛有碱石灰的干燥管)换成盛有浓硫酸的洗气瓶
⑹另一课外小组认为,该课外小组的实验装置及实验操作存在不足,请用简明文字说明,应采取何种措施或改进?_______________________________________________。
25.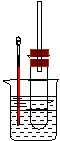 溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物。某同学依据溴乙烷的性质,用右图实验装置(铁架台、酒精灯略)验证取代反应和消去反应的产物,请你一起参与探究。
溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物。某同学依据溴乙烷的性质,用右图实验装置(铁架台、酒精灯略)验证取代反应和消去反应的产物,请你一起参与探究。
实验操作Ⅰ:在试管中加入5 mL 1 mol/L NaOH溶液和5 mL 溴乙烷,振荡。
实验操作II:将试管如图固定后,水浴加热。
(1)用水浴加热而不直接用酒精灯加热的原因是:
___________________ ___
(2)观察到__________________________现象时,表明溴乙烷与NaOH溶液已完全反应。
(3)为证明溴乙烷在NaOH乙醇溶液中发生的是消去反应,在你设计的实验方案中,需要检验的是生成的气体,请你设计两种不同的方法检验该气体。
|
|
所选试剂和操作方法 |
实验现象 |
|
1 |
|
|
|
2 |
|
|
24. 煤是一种重要的化石燃料,但直接燃烧煤不仅热值利用率低,而且对环境产生大量污染。煤在高温条件下与水蒸气作用,可制得合成气(CO与H2),进而合成一系列其他物质,大大提高了煤的利用价值。根据题意回答下列问题:
(1)煤直接燃烧对环境产生的危害是 。(举出一例即可)
(2)煤(主要含C)制合成气的化学方程式为 。
(3)由合成气在一定条件下合成乙醇时,还产生了一种无色液体,该反应的化学方程式是:
(4)由合成气制得的甲醇可与O2构成燃料电池。该电池以甲醇为燃料,O2为氧化剂,可用酸性电解质(如稀H2SO4),也可用碱性电解质(如KOH),还可用固体氧化物作电解质(如ZrO2 、Y2O3等)。
①当用酸性电解质时,负极的电极反应式为 。
②当用碱性电解质时,负极的电极反应式为 。
③用固体氧化物作电解质时,电极反应式为:负极 ,正极 。
(5)合成气通过一系列反应可制得尿素,有机物A、B与尿素含有相同的元素,且都既能与酸反应,又能与碱反应。A化学式为C2H5NO2,B为含有苯环的一种盐,化学式为C7H9NO2:A、B的结构简式分别为 、 。
23. 乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物。试回答下列问题:
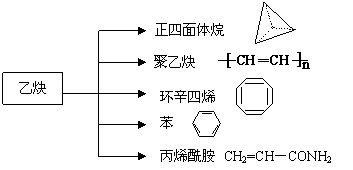

(1)正四面体烷的二氯取代产物有 种。
(2)关于聚乙炔分子的说法错误的是 (填字母符号)。C
A.能使酸性KMnO4溶液褪色
B.1 mol聚乙炔能与n mol Br2发生加成反应
C.等质量的聚乙炔与乙烯基乙炔(CH≡C-CH=CH2)完全燃烧时的耗氧量不相同
D.聚乙炔分子中的所有原子一定都共平面
(3)写出与环辛四烯互为同分异构体且属于芳香烃的分子的结构简式 。
(4)写出与苯互为同系物且一氯代物只有两种的物质的结构简式(举两例): 、
。
(5)丙烯酰胺是一种重要的有机合成中间体,以乙炔为原料合成丙烯酰胺的反应如下(反应均在一定条件下进行):乙炔 CH2=CHCN
CH2=CHCN 丙烯酰胺。反应Ⅰ和反应Ⅱ都符合绿色化学思想,是原子利用率100%的反应,反应Ⅰ所需另一反应物的结构式为
,以下反应中同样符合绿色化学思想的是
。
丙烯酰胺。反应Ⅰ和反应Ⅱ都符合绿色化学思想,是原子利用率100%的反应,反应Ⅰ所需另一反应物的结构式为
,以下反应中同样符合绿色化学思想的是
。
a. 取代反应 b. 消去反应 c. 缩聚反应 d. 加聚反应
22. 某兴趣小组利用右图装置,取不同浓度的硫酸与 3mL 无水乙醇和 2mL 冰醋酸分别进行制取乙酸乙酯的研究。该小组记录的实验现象和结果如下表:
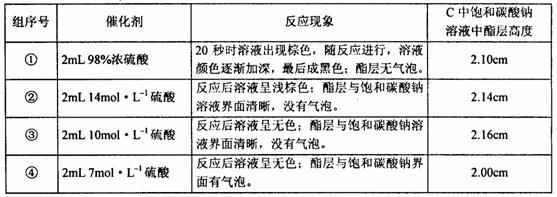
下列有关该实验的叙述不正确的是
A. 导气管 B 的管口没有插入饱和碳酸钠液面以下,其原因是防止碳酸钠液体倒吸,便于产物流出
B. 第①组实验中,试管内溶液颜色随反应进行逐渐加深,最后变成黑色的原因是98%的浓硫酸具有强氧化性,使部分反应物炭化
C. 加热有利于提高乙酸乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,可能的主要原因是大量乙酸、乙醇未经反应就脱离反应体系
D. 由实验结果可知,盐酸不能作酯化反应的催化剂
成都七中高2011级高二年级下期
有机化学单元考试试卷
第Ⅱ卷 非选择题(共50分)
21. 某有机物X(C4H6O5)广泛存在于许多水果内,尤以苹果、葡萄、西瓜、山楂内为多。该化合物具有如下性质
①1mol X与足量的金属钠反应产生1.5mol气体
②X与醇或羧酸在浓H2SO4和加热的条件下均生成有香味的产物
③X在一定程度下的分子内脱水产物(不是环状化合物)可和溴水发生加成反应
根据上述信息,对X的结构判断正确的是
 A X中可能有两个羧基和一个羟基
A X中可能有两个羧基和一个羟基
B X中可能有三个羟基和一个-COOR官能团
C X中可能有三个羧基
D X中肯定有碳碳双键
20. 某ABS工程树脂由丙烯腈(CH2=CHCN,符号A)、1,3-丁二烯(CH2=CHCH=CH2,符号B)和苯乙烯(
 -CH=CH2,符号S)按一定配比共聚而得。经元素分析可知该ABS样品的组成为CaHbNc(a、b、c为正整数),则原料中A和B的物质的量之比是
-CH=CH2,符号S)按一定配比共聚而得。经元素分析可知该ABS样品的组成为CaHbNc(a、b、c为正整数),则原料中A和B的物质的量之比是
A.c/(b-a) B.2c/(b-a) C.c/(a-b) D.2c/(a-b)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com