
2、电解质为碱性电解质溶液
例2、甲烷燃料电池的电解质溶液为KOH溶液,下列关于甲烷燃料电池的说法不正确的是 ( )
A、负极反应式为CH4+10OH--8e-=CO32-+7H2O
B、正极反应式为O2+2H2O +4e-=4OH-
C、随着不断放电,电解质溶液碱性不变
D、甲烷燃料电池的能量利用率比甲烷燃烧的能量利用率大
解析:因甲烷燃料电池的电解质为KOH溶液,生成的CO2还要与KOH反应生成K2CO3,故该电池发生的反应方程式是CH4+2OH-+2O2=CO32-+3H2O。从总反应式可以看出,要消耗OH-,故电解质溶液的碱性减小,C错。按上述燃料电池正极反应式的书写方法2知,在KOH溶液中,其正极反应式为:O2+2H2O +4e-=4OH-。通入甲烷的一极为负极,其电极反应式可利用总反应式减去正极反应式为CH4+10OH--8e-=CO32-+7H2O。选项A、B均正确。根据能量转化规律,燃烧时产生的热能是不可能全部转化为功的,能量利用率不高,而电能转化为功的效率要大的多,D项正确。
答案:C。
1、电解质为酸性电解质溶液
例1、科学家预言,燃料电池将是21世纪 获
获 得电力的重要途径,美国已计划将甲醇燃料用于军事目的。一种甲醇燃料电池是采用铂或碳化钨作电极催化剂,在稀硫酸电解液中直接加入纯化后的甲醇,同时向一个电极通入空气。
得电力的重要途径,美国已计划将甲醇燃料用于军事目的。一种甲醇燃料电池是采用铂或碳化钨作电极催化剂,在稀硫酸电解液中直接加入纯化后的甲醇,同时向一个电极通入空气。
试回答下列问题:
⑴这种电池放电时发生的化学反应方程式是 。
⑵此电池的正极发生的电极反应是 ;负极发生的电极反应是 。
⑶电解液中的H+离子向 极移动;向外电路释放电子的电极是 。
⑷比起直接燃烧燃料产生电力,使用燃料电池有许多优点,其中主要有两点:首先是燃料电池的能量转化率高,其次是  。
。
解析:因燃料电池电化学反应的最终产物与燃料燃烧的产物相同,又且其电解质溶液为稀硫酸,所以该电池反应方程式是2CH3OH+3O2=2CO2+4H2O。按上述燃料电池正极反应式的书写方法1知,在稀硫酸中,其正极反应式为:3O2+12H++12e-=6H2O,然后在电子守恒的基础上利用总反应式减去正极反应式即得负极反应式为:2CH3OH+2H2O-12e-=2CO2↑+12H+。由原电池原理知负极失电子后经导线转移到正极,所以正极上富集电子,根据电性关系知阳离子向正极移动,阴离子向负极移动。故H+离子向正极移动,向外电路释放电子的电极是负极。
答案:⑴2CH3OH+3O2=2CO2+4H2O
⑵正极3O2+12H++12 e-=6H2O;负极2CH3OH+2H2O-12e-=2CO2↑+12H+
e-=6H2O;负极2CH3OH+2H2O-12e-=2CO2↑+12H+
⑶正;负 ⑷对空气的污染较小
5. 可充电电池考点的综合应用
可充电电池考点的综合应用
例5、铅蓄电池是典型的可充型电池,它的正负极格板是惰性材料,电池总反应式为:
Pb+PbO2+4H++2SO42- 2PbSO4+2H2O
2PbSO4+2H2O
请回答下列问题(不考虑氢、氧的氧化还原):
⑴放电时:正极的电极反应式 是
;
是
;
电解 液中H2SO4的浓度将变
;当外电路通过1mol电子时,理论上负极板的质量增加 g。
液中H2SO4的浓度将变
;当外电路通过1mol电子时,理论上负极板的质量增加 g。
⑵在完全放电耗尽PbO2和Pb时,若按右 图连接,电解一段时间后,则在A电极上生成
、B电极上生成 ,此时铅蓄电池的正负极的极性将
。
图连接,电解一段时间后,则在A电极上生成
、B电极上生成 ,此时铅蓄电池的正负极的极性将
。
解析:⑴根据总反应式中化合价的升降,可判断出两极,从而写出它的两电极反应:负极:Pb+SO42--2e-=PbSO4,正极:PbO2+4H++SO42-+2e-=PbSO4+2H2O。根据总反应式H2SO4的浓度会不断减小,所以应定期补充H2SO4。根据负极反应:Pb+S O42--2e-=PbSO4,可知,每转移2 mol电子,负极板增加1mol的质量,因为负极板由Pb变为PbSO4,故外电路通过1mol电子时,理论上负极板的质量增加48g。
O42--2e-=PbSO4,可知,每转移2 mol电子,负极板增加1mol的质量,因为负极板由Pb变为PbSO4,故外电路通过1mol电子时,理论上负极板的质量增加48g。
⑵当外加电源后,铅蓄电池变成了电解池,A极为阴极,电极反应式为:
PbSO4+2e-=Pb+SO42-,B极为阳极,电极反应式为:PbSO4+2H2O-2e-=PbO2+4H++SO42-。这样,A电极上生成Pb,B电极上生成PbO2,此时铅蓄电池的正负极的极性将对换。
答案:⑴PbO2+2e-+4H++SO42-=PbSO4+2H2O 小 48 ⑵Pb PbO2 对换
点评:本题关于电化学,正确书写电极反应式是解决本类问题的关键。在书写过程中要注意,电极产物是否与电解质溶液共存,不共存要参与电极反应,如本题中的与Pb2+与SO42-不共存,要发生反应生成PbSO4。
4.可充电电池离子的移动方向判断及总反应式的书写
例4、锂离子电池已成为新一代实用化的蓄电池,该电池具有能量密度大、电压高的特性。锂离子电池放电时的电极反应式为:
负极反应:C6Li-xe-=C6Li1-x+xLi+(C6Li表示锂原子嵌入石墨形成的复合材料)
正极反应:Li1-xMO2+xLi++xe-=LiMO2(LiMO2表示含锂的过渡金属氧化物)
下列有关说法正确的是( )
A. 锂离子电池充电时电池反应为C6Li+Li1-xMO2=LiMO2+C6 Li1-x
Li1-x
B. 电池反应中锂、锌、银、铅各失1mol电子,金属锂所消耗的质量最小
C. 锂离子电池放电时电池内部Li+向负极移动
D. 锂离子电池充电时阴极反应为C6Li1-x+xLi++xe-=C6Li
解析:将放电的两电极反应式在电子守恒的基础上相加即得放电时的总反应式:C6Li+Li1-xMO2=LiMO2+C6Li1-x,充电时的总反应式应为放电总反应式的逆反应,故A错误;在锂、锌、银、铅金属中,锂的摩尔质量最小,所以各失去1mol电子,消耗金属锂的质量最小,B正确。电池工作时,阴离子向负极移动,阳离子向正极移动,C错误。充电时的阴极反应与放电时的负极反应互 为逆反应,故D正确。本题应选BD。
为逆反应,故D正确。本题应选BD。
点评:本题以锂离子电池为背景材料,全面考查了蓄电池的反应原理、电极反应、离子流向等知识,要求考生能将所学知识灵活迁移运用。
3.可充电电池电极发生氧化、还原反应及元素被氧化、被还原判断
例3、某可充电的锂离子电池以LiMn2O4为正极,嵌入锂的碳材料为负极,含Li+导电固体为电解质。放电时的电池反应为:Li+LiMn2O4=Li2Mn2O4。下列说法正确的是( )
A.放电时,LiMn2O4发生氧化反应
B.放电时,正极反应为:Li++LiMn2O4+e-=Li2Mn2O4
C.充电时,LiMn2O4发生氧化反应
D.充电时,阳极反应为:Li++e-=Li
解析:放电时作为电源来用,根据放电时的电池反应知,负极反应式为:Li-e-=Li+,正极反应式为:Li++LiMn2O4+e-=Li2Mn2O4, B正确,但LiMn2O4发生还原反应,A错误。充电时,阴极反应式为:Li++e-=Li,D错误,阳极反应式为:Li2Mn2O4-e-=
Li++LiMn2O4,故应是Li2Mn2O4发生氧化反应,而不是LiMn2O4,C错误。本题应选B。
B正确,但LiMn2O4发生还原反应,A错误。充电时,阴极反应式为:Li++e-=Li,D错误,阳极反应式为:Li2Mn2O4-e-=
Li++LiMn2O4,故应是Li2Mn2O4发生氧化反应,而不是LiMn2O4,C错误。本题应选B。
点评:本题主要考查电化学知识和氧化还原反应的有关知识,虽然新型电池增加了试题的陌生度,但考查原电池及电解池的原理不变,这是解答本类试题的关键。
2.可充电电池电极反应式的书写和判断
例2、高铁电池是一种新型可充电电池,与普通高能电池相比,该电池长时间保持稳定的放电电压。高铁电池的总反应为3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是( )
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是( )
A.放电时负极反应为:Zn-2e-+2OH-=Zn(OH)2
B.充电时阳极反应为:Fe(OH)3-3e-+5OH-=FeO42-+4H2O
C.放电时每转移3mol电子,正极有1mol K2FeO4被氧化
D.放电时正极附近溶液的碱性增强
 点评:本题主要考查电极反应式的书写、电解质溶液的酸碱性变化、及氧化还原反应等知识,侧重考查考生对原电池和电解池原理的理解及分析问题的能力。
点评:本题主要考查电极反应式的书写、电解质溶液的酸碱性变化、及氧化还原反应等知识,侧重考查考生对原电池和电解池原理的理解及分析问题的能力。
1.可充电电池电极极性和材料判断
例1、镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用,它的充放电反应按下式进行:Cd(OH)2+2Ni(OH)2  Cd+2NiO(OH)+2H2O。由此可知,该电池放电时的负极材料是( )
Cd+2NiO(OH)+2H2O。由此可知,该电池放电时的负极材料是( )
A.Cd(OH)2 B.Ni(OH)2
 C.Cd D.NiO(OH)
C.Cd D.NiO(OH)
解析:要理解镍镉电池放电和充电的过程。放电是原电池反应,根据题给条件知放电(原电池)时的总反应式为:Cd+2NiO(OH)+2H2O Cd(OH)2+2Ni(OH)2。标出原电池总反应式电子转移的方向和数目指出,即可知道参与负极反应的物质:
Cd(OH)2+2Ni(OH)2。标出原电池总反应式电子转移的方向和数目指出,即可知道参与负极反应的物质:
Cd+2NiO(OH)+2H2O=Cd(OH)2+2Ni(OH)2。
从上式可知,Cd可作负极材料,参与负极反应。
故应选C。
点评:此类试题考查可充电电池电极极性和材料判断,首先要准确判断充电、放电分别表示什么反应(原电池反应还是电解池反应),并写出充电、放电的总反应式,然后在总反应式上标出电子转移的方向和数目,即可正确判断可充电电池电极极性和材料。
39.(11分)下列是有关动物细胞培养技术的应用,请回答相关问题:
(1)要进行动物细胞培养首先必须获得细胞悬浮液,动物细胞培养液中通常含有无机盐、维生素、氨基酸、葡萄糖和 等。
(2)制备单克隆抗体的基础是动物细胞培养技术,单克隆抗体技术是将在体外培养条件下能 的小鼠骨髓瘤细胞与某一种 融合,筛选出能产生特定抗体的融合细胞,再大量培养,获得单克隆抗体。单克隆抗体与常规抗体相比,具有 的特点。
(3)应用动物细胞培养技术也可以用于检测能引起染色体变异的有毒物质。现有一种化学物质,不能确定其是否有毒性,请利用动物细胞培养技术设计一个实验来进行研究。实验及用具:略
实验步骤:
①取幼龄动物的胚胎,剪碎后用胰蛋白酶处理,得到 的胚胎细胞;
②配制动物细胞悬浮液;
③ ;
④ ;
将A、B两个培养瓶放入动物细胞培养箱中培养一段时间;
⑤分别从A、B培养瓶中取出细胞用龙胆紫溶液染色,制作临时装片,在显微镜下观察 。
预测实验结果,得出实验结论(略)
保定市高二第二学期期中联考
38.(9分)苏云金杆菌合成的伴孢晶体蛋白经昆虫肠液消化后成毒性肽,可导致昆虫死亡。1993年,我国农科院成功地将苏云金杆菌伴孢晶体蛋白质基因转移到了棉花细胞内,培育出了转基因抗虫棉。
(1)转基因抗虫棉细胞中的抗虫基因通常采用 的方法获得。
|
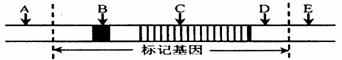 (2)如果下图中的标记基因是质粒(作运载体)中唯一的标记基因,那么目的基因不能插入的位点是图中的
处。(用图中的字母填写)
(2)如果下图中的标记基因是质粒(作运载体)中唯一的标记基因,那么目的基因不能插入的位点是图中的
处。(用图中的字母填写)
(3)要使运载体与抗虫基因连接,首先应使用 进行切割。假如运载体被切割后,得到的分子末端序列为 ,则能与该运载体连接的抗虫基因分子末端是 。采用 将运载体与抗虫基因连接,连接后得到的DNA分子称为 。
(4)将连接得到的DNA分子导入土壤农杆菌,然后用该菌去感染棉花细胞,利用 的表达来检测目的基因已经成功导入。再利用 技术将受体细胞诱导成具有抗虫能力的棉花小植株。
(5)基因工程成功的标志是 的成功表达。
37.(8分)如图表示的是生态系统中的氮循环示意图。
 (1)大气中的氮主要通过①过程中的
进入生物群落。若要从土壤中分离出圆褐固氮菌,需要选用的土壤取自于 (表层、中层、底层)。
(1)大气中的氮主要通过①过程中的
进入生物群落。若要从土壤中分离出圆褐固氮菌,需要选用的土壤取自于 (表层、中层、底层)。
(2)实现图中③过程的生物,是否属于固氮微生物? ;植物从土壤中吸收的硝酸盐主要以 方式进入细胞内部。 如果土壤板结或长期水淹,陆生植物通过该过程吸收的氮素 (能、不能)满足其生理需要。此种情况下, (填标号)代表的生理过程会增强。
(3)鸡粪发酵除臭是 (生物名称)的作用。在图中标号 所示的过程能反映除臭的生理过程。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com