
27、(15分)草酸(H2C2O4)是一种二元弱酸,它在水溶液中的存在形式的分布与pH关系如下图所示:

1- H2C2O4 2- HC2O4- 3- C2O42-
(1)欲采用草酸为沉淀剂测定钙离子(生成CaC2O4)沉淀)时,溶液的pH值应维持在(填字母) 。
A. 0~1 B. 1~3 C. 3~5 D. ≥5
(2)Na2C2O4溶液中,
 (填“>”、“<”或“=” =)。
(填“>”、“<”或“=” =)。
(3) H2C2O4是用来标定KMnO4常用的基准物质,一般开始滴定时,控制溶液的c(H+)大约为0.5~1mol/L,该滴定反应的离子方程式为 。
(4)用H2C2O4标定KMnO4时,应将溶液加热至75~85℃,不在此温度范围时不利于滴定分析,理由是 。
(5)下表为物质的量浓度相同的几种酸对铁锈及锅炉水垢的溶解性的比较:
|
酸 |
铁锈[Fe(OH)3]溶解量/g |
水垢(CaCO3)溶解量/g |
|
盐酸 |
0.7911 |
全溶 |
|
磷酸 |
0.1586 |
微溶 |
|
草酸 |
0.7399 |
0.0036 |
|
醋酸 |
0.1788 |
0.1655 |
下列推断可能正确的有 (填字母)。
A. 酸性越强的酸除铁锈效果越好
B. 草酸除水垢效果差的原因是因为草酸酸性太弱
C. 铁锈或水垢在酸中的溶解性与酸根离子的性质可能有关
 D. 硫酸除铁锈和水垢的效果都好
D. 硫酸除铁锈和水垢的效果都好
26、(8分)硫酸亚铁铵又称莫尔盐,浅绿色晶体,在空气中比一般的亚铁盐稳定,溶于水但不溶于乙醇,化学式为[(NH4)2SO4·FeSO4·6H2O],相对分子质量为392,是常用的分析试剂。在实验室,将FeSO4和(NH4)2SO4两种溶液按一定比例混合,蒸发浓缩、冷却结晶,很容易得到硫酸亚铁铵晶体。某研究性学习小组已制备得到莫尔盐,准备分析研究他们得到的产品。请你帮助完成部分项目:
(1)预测现象:向盛有莫尔盐溶液的大试管中滴加浓NaOH溶液,并不断振荡。
。
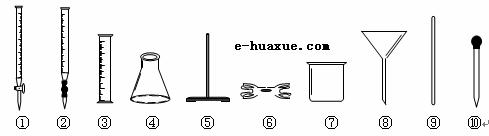
(2)为了确定产品中亚铁含量,研究小组经查阅资料后,打算用KMnO4(酸化)溶液滴定莫尔盐溶液中的Fe2+。离子方程式为:5Fe2++MnO4-+8H+=5Fe2++Mn2++4H2O。滴定时必须选用的仪器有 (从下图所列仪器中选填编号,同种仪器数量不限);滴定时是否需要加加指示剂? 。若需要,请指出加什么指示剂;若不需要,请说明理由。 。
(3)取莫尔盐产品23.520g,配成250mL溶液,取出25.00mL用0.0500mol/LKMnO4溶液滴定,消耗KMnO4溶液19.50mL,则产品中莫尔盐的质量分数 。
25、(12分)废旧印刷电路板的回收利用可实现资源再生,并减少污染。废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末
(1)废旧印刷电路板中回收的铁是新型电池的使用材料,如制成LiFePO4电池,它可用于电动汽车。电池反应为:FePO4+Li
 LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,含Li+导电固体为电解质。放电时其正极反应方程式为:
LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,含Li+导电固体为电解质。放电时其正极反应方程式为:
(2)用H2O2 和H2SO4 的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
Cu(s)+2H+(aq)=Cu2+(aq)+H2(g) △H=64.39kJ·mol-1
2H2O2(l)=2H2O(l)+O2(g) △H=-196.46kJ·mol-1
H2(g)+1/2O2(g)=H2O(l) △H=-285.84kJ·mol-1
则在H2SO4 溶液中Cu 与H2O2 反应生成Cu2+和H2O的热化学方程式为: 。
(3)部分金属的回收需要氧化性很强的溶液,如金常用 和 的混合溶液溶解
(4)为了分离金属粉末常用到氰酸(HCN)溶液,HCN是一种有毒且较弱的酸,已知:常温下HCN的电离程度非常小,其Ka=6.2×10-10,0.1mol/L的NaCN的pH=11.1,0.1mol/L的NH4CN的pH=9.2, 则浓度都是0.1mol/L的NaCN和NH4CN溶液中,CN-水解程度大小为:NaCN NH4CN(填:> = < ),理由是:
24、(4分)101.3kPa下,溴乙烷、乙酸、乙酸乙酯的沸点分别为38.2℃、117.9℃、77.1℃。在实验室里,制取少量的以上三种物质均可用下图中的发生装置。回答下列问题:

收集 时,使用甲装置,甲中所装试剂为 ;
收集 时,使用乙装置;收集 时,使用丙装置。
23、常温时,将V1mL c1 mol/L的醋酸滴加到V2mL c2 mol/L的烧碱溶液中,下列结论正确的是
A.若V1=V2,且混合溶液pH<7,则必有c1<c2
B.若V1=V2,c1=c2,则混合溶液中c(OH-)=c(CH3COOH)+ c(H+)
C.若混合溶液的pH>7,则混合溶液中c(Na+) <c(CH3COO-)
D.若混合溶液的pH=7,则混合溶液中c(Na+)=c(CH3COO-)+c(CH3COOH)
第II卷(共54分)
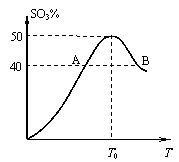
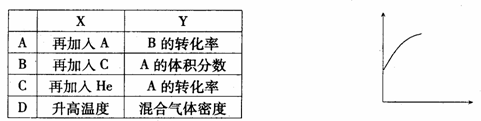
22、在一密闭容器中通入A、B两种气体,一定条件下发生如下反应:2A(g)+B(g) 2C(g);△H<0。达到平衡后,只改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是
2C(g);△H<0。达到平衡后,只改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是
21、 在盛有足量A的体积可变的密闭容器中,加入B ,发生反应:A (s) + 2B (g)
在盛有足量A的体积可变的密闭容器中,加入B ,发生反应:A (s) + 2B (g)  4 C(g) + D (g);△H < 0 。在一定温度、压强下达到平衡。平衡时C的物质的量与加入的 B 的物质的量的变化关系如右图。下列说法正确的是
4 C(g) + D (g);△H < 0 。在一定温度、压强下达到平衡。平衡时C的物质的量与加入的 B 的物质的量的变化关系如右图。下列说法正确的是
A.平衡时 B 的转化率为 50 %
B.若再加入B ,则再次达到平衡时正、逆反应速率均增大
C.若保持压强一定,再加人B ,则反应体系气体密度减小
D.若保持压强一定,当温度升高10 ℃ 后,则图中 θ > 45°
20、下列结论均出自《实验化学》中的实验,其中不正确的是
A.往新配制的可溶性淀粉溶液中滴加碘水,溶液显蓝色,用CCl4不能从中萃取出碘。
B.当锌完全溶解后,铁与酸反应产生氢气的速率会显著减慢,此现象可作为判断镀锌铁皮中锌镀层是否完全被反应掉的依据。
C.提取海带中碘元素时,为保证I-完全氧化为I2,加入的氧化剂(H2O2或新制氯水)均应过量。
D.制备硫酸亚铁铵晶体时,最后在蒸发皿中蒸发浓缩溶液时,只需小火加热至溶液表面出现晶膜为止,不能将溶液全部蒸干。
19、用二根铂丝作电极插入KOH溶液中,分别向两极通人甲烷和氧气,可作为一种燃料电池的模拟装置。试判断下列说法正确的是
A.通氧气的铂极为负极 B.此电池反应为CH4+2O2=CO2+2H2O
C.此电池放电时,KOH浓度减小 D.此电池放电时,KOH浓度不变
18、 城市环境污染是当前突出的环境问题。如图A所示,X河流经某工业城市Y,其中a处在上游,附近有丰富的黄铁矿资源,d处在下游有多个企业以硫酸为原料。根据某月Y市环保局监测站对X河水质检测的结果,绘制成简图如图B所示。下列说法不正确的
城市环境污染是当前突出的环境问题。如图A所示,X河流经某工业城市Y,其中a处在上游,附近有丰富的黄铁矿资源,d处在下游有多个企业以硫酸为原料。根据某月Y市环保局监测站对X河水质检测的结果,绘制成简图如图B所示。下列说法不正确的
A.造成X河污染的主要污染源最可能分布在bc段
B.工业生活污水、固体废弃物等可能是造成X河污染的污染源
C.d处污染程度减小,可能是某些污染物的离子间发生反应生成沉淀所致
D.该城市建造硫酸厂时,综合考虑诸多因素选址在b处最合理
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com