
8.函数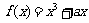 在
在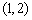 处的切线方程为 ▲ .
处的切线方程为 ▲ .
7.设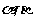 为互不重合的平面,W#W$W%.K**S*&5^U
为互不重合的平面,W#W$W%.K**S*&5^U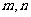 是互不重合的直线,给出下列四个命题:
是互不重合的直线,给出下列四个命题:
①
②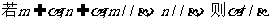
③
④若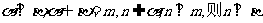 ;
;
其中正确命题的序号为 ▲ .
6.若将函数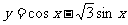 的图象向左移
的图象向左移 个单位后,所得图象关于y轴对称,
个单位后,所得图象关于y轴对称,
 则实数
则实数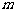 的最小值为 ▲ .
的最小值为 ▲ .
5.从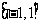 内任意取两个实数,这两个数的平方和小于1的概率为 ▲ .
内任意取两个实数,这两个数的平方和小于1的概率为 ▲ .
4.某人5 次上班所花的时间(单位:分钟)分别为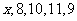 ,若这组数据的平均数为10,
,若这组数据的平均数为10,
则其方差为 ▲ .
3.复数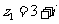 ,
, ,则复数
,则复数 在复平面内对应的点位于第
▲ .象限.
在复平面内对应的点位于第
▲ .象限.
2.“ ”是“
”是“ ”的
条件.(充分不必要、必要不充分、充要、既不充分又不必要)
”的
条件.(充分不必要、必要不充分、充要、既不充分又不必要)
1.已知集合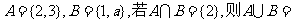 ▲ .
▲ .
4、化学反应与能量转化(选修四)
①能正确书写化学方程式,并能根据质量守恒定律进行有关计算。(初中化学需要掌握的内容)
[研究题25](2007 江苏)在隔绝空气的条件下,某同学将一块部分被氧化的钠块用一张已除氧化膜、并用针刺一些小孔的铝箔包好,然后放入盛满水且倒置于水槽中的容器内。待钠块反应完全后,在容器中仅收集到1.12 L氢气(标准状况),此时测得铝箔质量比反应前减少了0.27g,水槽和容器内溶液的总体积为2.0 L,溶液中NaOH的浓度为0.050mol·L-1(忽略溶液中离子的水解和溶解的氢气的量)。
(1)写出该实验中发生反应的化学方程式。
(2)试通过计算确定该钠块中钠元素的质量分数。
② P1及必修二P30能说明化学反应中能量转化的原因,知道化学变化中常见的能量转化形式。化学反应中能量转化的原因: 常见的能量转化形式:
[研究题26](08广东卷)下列有关能量转换的说法正确的是( )
A.煤燃烧是化学能转化为热能的过程
B.化石燃料和植物燃料燃烧时放出的能量均来源于太阳能
C.动物体内葡萄糖被氧化成CO2是热能转变成化学能的过程
D.植物通过光合作用将CO2转化为葡萄糖是太阳能转变成热能的过程
③ P31~32了解化学能与热能的相互转化及其应用。了解吸热反应、放热反应、反应热(焓变)的概念。
吸热反应: 常见的吸热反应: 放热反应:
反应热(焓变): 表达符号:
单位: 计算方法: 。
④ P3~4及P12~14能正确书写热化学方程式,能用盖斯定律进行简单化学反应反应热的计算。
[研究题27].(08海南卷)白磷与氧可发生如下反应:P4+5O2=P4O10。已知断裂下列化学键需要吸收的能量分别为:P-P akJ·mol-1、P-O bkJ·mol-1、P=O ckJ·mol-1、O=O dkJ·mol-1。
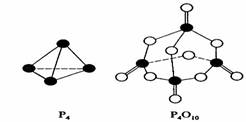
根据图示的分子结构和有关数据估算该反应的△H,其中正确的是( )
A.(6a+5d-4c-12b)kJ·mol-1 B(4c+12b-6a-5d)kJ·mol-1
C.(4c+12b-4a-5d)kJ·mol-1 D.(4a+5d-4c-12b)kJ·mol-1
⑤ 必修一P33~36 认识氧化还原反应的本质,了解氧化还原反应在生产、生活中的应用。
[研究题28](2007全国卷Ⅰ 10)已知氧化还原反应
2Cu(IO3)2+24KI+12H2SO4=2CuI↓+13I2+12K2SO4+12H2O
其中1mol氧化剂在反应中得到的电子为( )
A.10 mol B.11 mol C.12 mol D.13 mol
⑥ P71~72与P79~80及必修二P36~41 理解原电池和电解池的工作原理,能写出常见的简单电极反应和电池反应方程式。
构成原电池的条件:
简述原电池的工作原理:
简述电解池的工作原理
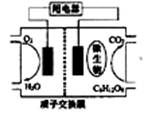 [研究题29](20009江苏12.) 以葡萄糖为燃
[研究题29](20009江苏12.) 以葡萄糖为燃
料的微生物燃料电池结构示意图如图所示。
关于该电池的叙述正确的是:
A.该电池能够在高温下工作
B.电池的负极反应为:
C6H12O6+6H2O-24e-=6CO2+24H+
C.放电过程中,H+从正极区向负极区迁移
D.在电池反应中,每消耗1mol氧气,理论上能生成标准状况下
CO2 22.4/6 L
⑦ P74~79及必修二P39~41了解常见的化学电源,认识化学能与电能相互转化的实际意义及其重要应用。
列举常见的化学电源,并写出他们的电极反应式和总反应方程式
铅蓄电池
负极: 正极:
总反应方程式:
阴极: 阳极:
总反应方程式:
氢氧燃料电池
(强酸性介质)负极: 正极:
总反应方程式:
(强碱性介质)负极: 正极:
总反应方程式:
其它燃料电池:甲烷/氧气(强酸性、强碱性); 甲醇/氧气(强酸性、强碱性);
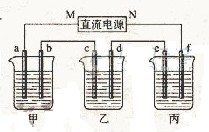 [研究题30]
[研究题30] (2009全国1卷28)
(2009全国1卷28)
 下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100 g 5.00%的NaOH溶液、足量的CuSO4溶液和100 g 10.00%的K2SO4溶液,电极均为石墨电极。
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100 g 5.00%的NaOH溶液、足量的CuSO4溶液和100 g 10.00%的K2SO4溶液,电极均为石墨电极。
 (1)接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加。据此回答问题:
(1)接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加。据此回答问题:
 ①电源的N端为______极;
①电源的N端为______极;
 ②电极b上发生的电极反应为_______________;
②电极b上发生的电极反应为_______________;
 ③列式计算电极b上生成的气体在标准状况下的体积:
③列式计算电极b上生成的气体在标准状况下的体积:
 _________________________
_________________________
 ④电极c的质量变化是_________g;
④电极c的质量变化是_________g;
 ⑤电解前后各溶液的酸、碱性大小是否发生变化,简述其原因:
⑤电解前后各溶液的酸、碱性大小是否发生变化,简述其原因:
 甲溶液_____________________;
甲溶液_____________________;
 乙溶液_____________________;
乙溶液_____________________;
 丙溶液_______________________;
丙溶液_______________________;
 (2)如果电解过程中铜全部析出,此时电解能否继续进行,为什么?
(2)如果电解过程中铜全部析出,此时电解能否继续进行,为什么?
 ___________________________。
___________________________。
⑧ P84~86 认识金属腐蚀的危害,理解金属发生电化学腐蚀的原因,能选用恰当的措施防止铁、铝等金属腐蚀。金属腐蚀的种类: ,怎么理解?
危害有哪些?
金属发生电化学腐蚀的原因(以铁制品为例):
防止铁腐蚀的措施有哪些?
防止铝腐蚀的措施有哪些?
[研究题31](2007 山东理综29)铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式 。
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式。正极反应 负极反应 。
(3)腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10mol/L·L-1,请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤 。
|
|
氢氧化物开始沉淀时的pH |
氢氧化物沉淀完全时的pH |
|
Fe3+ Fe2+ Cu2+ |
1.9 7.0 4.7 |
3.2 9.0 6.7 |
|
提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu |
(4)某科研人员发现劣质不锈钢在酸中腐蚀缓慢,但在某些盐溶液中腐蚀现象明显。请从上表提供的药品中选择两种(水可任选),设计最佳实验,验证劣质不锈钢腐蚀。
有关反应的化学方程式:__________________________________。
劣质不锈钢腐蚀的实验现象:__________________________________。
⑨P8~9及必修二P39~41了解提高燃料的燃烧效率、开发高能清洁燃料和研制新型化学电源的重要性。认识化学在解决能源危机中的重要作用。
如何提高燃料的燃烧效率?
如何缓解能源危机?
[研究题32](08江苏卷)化学与生活、社会密切相关。下列说法不正确的是( )
A.利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境
B.凡含有食品添加剂的食物对人体健康均有害,不可食用
C.为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术
D.提倡人们购物时不用塑料袋,是为了防止白色污染
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com