
23、下列实验操作不正确的是。
A.吸滤完毕停止吸滤时,应先拆下连接抽气泵和吸滤瓶的橡皮管,再关闭水龙头。
B.分液操作时,分液漏斗中的下层液体从下口放出,上层液体从上口倒。
C.萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大。
D.蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口。
第II卷 (非选择题 共49分)
22、工业上制备纯硅反应的热化学方程式如下:
SiCl4(g)+2H2(g)
= Si(s)+4HCl(g)  mol(Q>0)
mol(Q>0)
某温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1 mol,则达平衡时,吸收热量为Q kJ
C.反应至4 min时,若HCl浓度为0.12 mol/L,则H2的反应速率为0.03 mol/(L·min)
D.当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol/L的NaOH溶液恰好反应
21、实验测得常温下0.1 mol/L某一元酸(HA)溶液的pH不等于l, 0.1 mol/L某一元碱(BOH)溶液里:c(H+)/ c(OH-)=10-12。将这两种溶液等体积混合后,所得溶液里各离子的物质的量浓度的关系正确的是
A.c(A-)>c(B+)>c(H+)>c(OH-) B. c(B+)>c(A-)>c(OH-)>c(H+)
C.c(B+)+c (H+)>c(A-)+c(OH-) D.c(B+)>c(A-)>c(H+)>c(OH-)
20、亚硝酸钠的外观与食盐相似,又称“工业食盐”,因此常出现误食工业食盐导致中毒的事件。化学上有许多方法可以用于鉴别食盐和“工业食盐”,下列方法可行的是
①加入稀硫酸,微热,看能否产生红棕色气体。②加入酸化的碘化钾淀粉溶液,看溶液是否变蓝。③加入酸化的氯化亚铁溶液,看溶液是否变成棕黄色。④加入酸性高锰酸钾溶液,看能否褪色。⑤加入硝酸酸化的硝酸银溶液,看能否产生白色沉淀。
A.只有①②③④ B.只有②③④⑤ C.只有③④⑤ D.①②③④⑤
19、亚氯酸盐(NaClO2)可作漂白剂,在常温下不见光时可保存一年,但在酸性溶液里因生成亚氯酸而发生分解:5HClO2=4ClO2↑+H++Cl-+2H2O。开始时,分解反应非常慢,随后突然释放出很多的ClO2。对于以上分解速率变化的原因,下列猜测最合理的是
A.酸使亚氯酸的氧化性增强 B.溶液中的H+起催化剂的作用
C.溶液中的Cl-起催化剂的作用 D.逸出的ClO2使反应的生成物的浓度降低
18、将H2(g)和Br2(g)充入恒容密闭容器,恒温下发生反应H2(g)+Br2(g)  2HBr(g)
2HBr(g)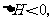 平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b。a与b的关系是
平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b。a与b的关系是
A.a>b B.a=b C.a<b D.无法确定
17、在一定温度下的定容容器中,当下列物理量不再发生变化时,表明反应:A(s)+2B(g)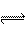 C(g)+ D(g)已达平衡状态的是
C(g)+ D(g)已达平衡状态的是
A.混合气体的压强 B.混合气体的密度
C.A的密度 D.气体总物质的量
16、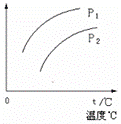 在容积一定的密闭容器中发生可逆反应A(g)+2B(g)
在容积一定的密闭容器中发生可逆反应A(g)+2B(g)
 2C(g);△H>0,平衡移动关系如图所示。下列说法正确的是
2C(g);△H>0,平衡移动关系如图所示。下列说法正确的是
A.P1>P2,纵坐标指A的质量分数
B.P1> P2,纵坐标指C的质量分数
C.P1< P2,纵坐标指A的转化率
D.P1< P2,纵坐标指混合气体的平均摩尔质量
15、为比较Fe3+和Cu2+对H2O2分解反应的催化效果,甲乙两组同学分别设计了如图1、图2所示的实验。下列叙述中不正确的是
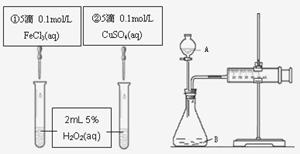

A.图1实验可通过观察产生气泡快慢来比较反应速率的大小
B.若图1所示实验中反应速率为①>②, 则一定说明Fe3+比Cu2+对H2O2分解催化效果好
C.用图2装置测定反应速率,可测定反应产生的气体体积及反应时间
D.为检查图2装置的气密性,可关闭A处活塞, 将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位
14、在氧气中灼烧0.44 g硫和铁组成的化合物,使其中的硫全部转化为SO2,把这些SO2全部转化为H2SO4,这些硫酸可被20mL 0.50mol/LNaOH溶液恰好中和,则原化合物中硫的质量分数约为
A.18% B.36% C.46% D.53%
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com