
5.常温下,有甲、乙两份体积均为1L,pH均为3的溶液,其中甲为醋酸,乙为盐酸。①甲用蒸馏水稀释至100倍后,溶液的pH变为a;②乙与等体积、浓度为0.01mol/L的氨水混合,在此混合液中:n(NH4+)+n(H+)-n(OH-)= bmol。则a、b正确的答案组合是 ( )
A.3~5之间;0.0005 B.3~5之间;0.001
C.5;0.0005 D.5;0.001
4.用NA表示阿伏加德罗常数的值,下列叙述正确的是 ( )
A.32g氧气和臭氧的混合气体中含有的氧原子数为2NA
B.标准状况下,22.4LCH3CH2Br中所含分子数为NA
C.0.1molH3O+所含质子数为NA
D.0.1molFe和足量的稀硝酸充分反应,转移电子数为0.2 NA
3.下列各组离子中,加入盐酸或NaOH溶液都能大量共存的离子组是 ( )
A.Al3+、K+、HC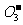 、
、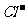 B. Na+、Cl-、SO42- 、
B. Na+、Cl-、SO42- 、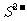
C.Na+ 、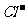 、
、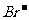 、
、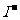 D.Na+ 、K+、Fe2+、NO3-
D.Na+ 、K+、Fe2+、NO3-
2.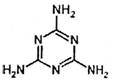 2008年9月的“结石宝宝”事件主要是婴儿饮用了添加有三聚氰胺的奶制品导致的肾结石和输尿管结石。三聚氰胺是一种用途广泛的基本有机化工中间产品,长期服用该物质后会引起肾衰竭。其结构式如右图:
2008年9月的“结石宝宝”事件主要是婴儿饮用了添加有三聚氰胺的奶制品导致的肾结石和输尿管结石。三聚氰胺是一种用途广泛的基本有机化工中间产品,长期服用该物质后会引起肾衰竭。其结构式如右图:
下列关于三聚氰胺的说法不正确的是 ( )
A.三聚氰胺是劣质蛋白质
B.三聚氰胺中氮元素的含量高于蛋白质中氮的含量
C.三聚氰胺在一定条件下可能会与氢气发生加成反应
D.三聚氰胺的化学式为C3H6N6
1.2007年10月24日我国“嫦娥一号”探月火箭发射升空,这标志中国实施绕月探测工程迈出重要一步。其任务之一是开展月面的微波辐射探测,估算月壤中3He的分布和资源量。以下关于3He的说法正确的是 ( )
A.是4He 的同素异形体 B.比4He 少一个电子
C.是4He 的同位素 D.比4He少一个质子
29.(20分)某化学活动兴趣小组的同学利用右图进行木炭还原CuO的探究实验。已知:
C+2CuO 2Cu+CO2↑
2Cu+CO2↑
C+CuO Cu+CO↑
Cu+CO↑
⑴该装置中试管口略向下倾斜的原因是: ;实验结束时,应 (填“先”或“后”)拔掉试管上的橡皮塞,原因是:
(2分)。
⑵有同学认为该装置a处可能有CO冒出,他的理由是 。
由此,请你提出对上述C和CuO反应的装置的改进建议(只要求写两点)
; 。
⑶他们通过查阅资料后,得知氧化亚铜(Cu20)为红色固体。
①请从元素守恒和元素质量分数两个方面说明生成的红色固体中可能存在氧化亚铜的原因:
、
②又知:Cu20能和常见的酸(HNO3除外)反应生成Cu2+和Cu、H2O;Cu不能与常见的酸(HNO3除外)反应。请你设计一个简便的实验方案,证明红色固体中含有Cu2O。(每空2分,共6分)
|
实验步骤 |
|
|
实验现象与结论 |
|
|
化学反应方程式 |
|
⑷已知2Fe203+3C 4Fe十3CO2↑,
4Fe十3CO2↑,
如果C的量少一些,还会发生如下反应:2Fe203+C 4FeO十CO2↑
4FeO十CO2↑
①当碳与氧化铁的质量比为 时,氧化铁会被还原成氧化亚铁;(2分)
②合成氨工业生产中所用的α-Fe催化剂的主要成分是FeO、Fe203。
当催化剂中FeO与Fe203的质量之比为9:20时,其催化活性最高,此时铁的氧化物混合物中铁的质量分数为多少?(保留2位小数)(2分)
③以Fe203为原料制备上述催化剂,为制得这种活性最高的催化剂100g,应取Fe203 粉末的质量多少克 ?(1分)
高邮市赞化学校
28.(9分)请根据图示回答下列问题:
 (1)写出图中标号的仪器名称:①
,②
;
(1)写出图中标号的仪器名称:①
,②
;
(2)实验室欲用高锰酸钾制取氧气,应选择的气体发生装置是 ,产生氧气的化学方程式为 ;
(3)已知过氧化钠(Na2O2)是一种淡黄色固体,常温下可与水反应生成氢氧化钠和氧气。如果在实验室中用A装置作气体发生装置,用过氧化钠和水反应来制取一瓶干燥的氧气,所选装置的正确连接顺序是(填写管口字母)
a → 。若只改变A装置中的药品,仍采用已连接的整套装置,还可以用来制取的气体是 。
(4)通过上述两种制取氧气的方法所选用发生装置的对比,你觉得选择气体发生装置应考虑的因素是 ;(2分)
(5)装置A和C都可以作为实验室制取同种气体的发生装置,A和C相比,具有哪些优点?(只答出一条即可) 。
27.(5分)小明同学根据NaCl+AgNO3=AgCl↓+NaNO3这一反应原理,对一瓶生理盐水进行分析时,不知道加入的硝酸银溶液与氯化钠溶液是否恰好完全反应,于是他设计了一个实验方案进行探究。请你帮他完善该实验方案。
|
探究步骤 |
可能观察到的现象 |
结论 |
|
(1)取反应后的上层清液于试管中,滴加 溶液 |
若有白色沉淀生成 |
氯化钠溶液过量 |
|
若无白色沉淀生成 |
还需进行下一步探究 |
|
|
(2)另取反应后的上层清液于试管中,滴加
溶液 |
|
|
|
|
说明硝酸银溶液与氯化钠溶液恰好完全反应。 |
26.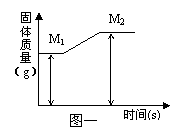 (4分)化学反应遵循质量守恒定律。
(4分)化学反应遵循质量守恒定律。
(1)镁带在空气中完全燃烧后生成氧化镁,其固体质量变
化可用图一表示,则:M2与M1质量差表示的质量是
(填序号):
A.生成MgO的质量; B.Mg的质量;
C.参加反应的O2的质量; D.多余的O2的质量。
 (2)小凤同学用空气中燃烧镁带的实验来探究质量守恒定律。
(2)小凤同学用空气中燃烧镁带的实验来探究质量守恒定律。
镁点燃后的实验现象如图二,镁完全燃烧后,称量石棉网
上留下固体的质量比反应前镁带质量还轻(只考虑氧气参加
反应),联系实验现象,分析其原因可能是
等。
(3)小凤又在一本参考书上发现,镁也能在二氧化碳中燃烧!
 于是她做了这个实验(如图三),将镁条点燃后迅速伸入
于是她做了这个实验(如图三),将镁条点燃后迅速伸入
盛有二氧化碳的集气瓶中,发现镁条剧烈燃烧,发出白光
放热,产生一种白色粉末和一种黑色粉末。根据上述
现象,写出该反应的化学方程式:
;
这个实验还引发了我们对过去某些知识的反思,从而有了新的
发现,你认为新的发现是 (填序号):
A.在一定的条件下,二氧化碳也能支持燃烧;
B.活泼金属着火时不能用二氧化碳灭火;
C.燃烧不一定需要有氧气。
25.(5分) 随着生活水平的提高,人们越来越关注自身的健康。以下是探讨化学物质与人体健康的几个问题。
(1)植物为人类提供了大量营养物质,某些儿童由于偏食(不爱吃蔬菜、水果),结果生长发育出现障碍,患营养缺乏症,这些病症曾成为医学难题。这是由于摄入
(选填字母:A. 维生素 B.油脂 C. 蛋白质)不足而引起的。
(2)微量元素与人体健康密切相关,若膳食不合理,摄入某种微量元素不足,就会引起疾病。下列元素中不属于人体必需的微量元素的是 (选填:A. 锌 B. 氮 C. 铜 D.汞 E铁 F. 碘)。
(3)人体摄入过多食物时,会引起过多胃酸分泌,胃液的pH下降,使人体感到不适,此时服用消酸剂能有效调节胃内的pH,双羟基铝酸钠就是一种常用消酸剂,其化学式为NaAl(OH)2CO3,它由 种元素组成,它的相对分子质量为 。由于Al3+在人体内难以代谢,含量高了就会造成许多疾病,如老年痴呆症。请再举生活中-例,说明铝元素是如何进入人体的 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com