
26.(14分)实验室有一瓶Na2SO3固体,可能含有NaCl、Na2SO4、BaCl2、K2CO3、K2SO4中的一种或几种杂质,通过下列实验确定该样品的成分及Na2SO3的质量分数。
①取少量样品于试管中,加水振荡,未见沉淀生成;
②透过蓝色钴玻璃观察,焰色反应无紫色;
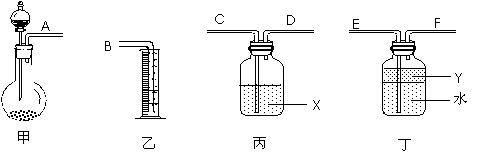 ③用下图所示仪器进行合理组装,测定产生气体的体积(SO2在硫酸中的溶解忽略不计)
③用下图所示仪器进行合理组装,测定产生气体的体积(SO2在硫酸中的溶解忽略不计)
请回答下列问题:
⑴按气流从左到右方向,正确的连接顺序为:A接___,___接____,____接B。
⑵利用所组装置,由分液漏斗向圆底烧瓶中滴加10mL水,将排入量筒中___mL液体。
⑶液体X是____________,其作用是______________________________。
⑷Y的作用是防止产生的气体溶于水,下列所给试剂符合要求的是______。
A.苯 B.四氯化碳 C.酒精 D.汽油
若称取样品3.00g,加入10.0mol/L的硫酸至过量(5mL),产生无色气体,排入量筒中液体的体积为229mL(标准状况)。
⑸对获得准确的气体体积无益的操作有_________(填序号)
①检查装置的气密性;
②连通乙、丁的导管要预先注满水;
③读数时视线与量筒内凹液面最低点相平;
④恢复到室温后再上下调整量筒位置,使乙、丁两液面相平;
⑤在甲装置胶塞上再连接一个导管,通入N2将系统中SO2全部排出。
⑹向逸出气体后的溶液中加入稍过量的BaCl2溶液,过滤、洗涤、干燥,得到白色沉淀13.98g。根据实验所得现象及数据,可知:样品中Na2SO3的质量分数是_____,含有的杂质是__________________。
25.(12分)居室是我们日常生活中最重要的场所。现代人在“煤烟型”、“光化学烟雾”污染后,正在进入以“室内空气污染”为标志的第三污染时期。造成室内环境污染的有毒物质主要有甲醛、苯、氨、氡四种。
请回答下列问题:
(1)氨分子的电子式是 ,苯分子的空间构型为 。
(2)提出减少室内空气污染的一条措施: 。
(3)我国《室内空气质量标准》规定室内空气中甲醛含量不得超过0.08mg•m-3,甲醛测定的方法主要有分光光度法、色谱法、电化学法、化学滴定法等。某校研究性学习小组的同学拟采用化学滴定法对教室内空气中甲醛的含量进行测定,如果你参与该研究课题,你采集甲醛样品的方法是 。
(4)碘量法是化学滴定法之一。碘量法原理为在碱性介质(NaOH)中,碘转化为次碘酸钠和碘化钠,次碘酸钠将溶液中游离的甲醛氧化为甲酸钠;经适当酸化后,剩余的次碘酸钠与碘化钠又生成碘;以淀粉为指示剂,用硫代硫酸钠标准溶液滴定。
上述过程中涉及的化学反应的离子方程式依次为: ①I2+2OH-====IO- + I- + H2O 、② 、③ 、④I2+2S2O32-====S4O62-+2I-。
实验过程中需要测定的数据除总碘量外,还有 。
24.(10分) 碱式氯化铜(Cupric
Chloride,不溶于水的绿色结晶)是一种农药,分子式:CuCl2·3Cu(OH)2·xH2O(x=1/2,1,2)。为验证其组成并确定X值,某学生设计了以下几步实验:
碱式氯化铜(Cupric
Chloride,不溶于水的绿色结晶)是一种农药,分子式:CuCl2·3Cu(OH)2·xH2O(x=1/2,1,2)。为验证其组成并确定X值,某学生设计了以下几步实验:
①取a g的晶体研成粉末。
②晶体在空气中加热至确认质量不再变化为止(铜仍为二价),冷却后称其质量为b g。
③另取a g的晶体,溶于足量某溶液中充分溶解得到溶液。
④向③得到的溶液中加入足量的硝酸银溶液,最后得到纯净固体称量为c g。
若以上操作均正确,试回答下列问题:
(1)以上实验中用到玻璃棒的步骤有 ____ (填序号)。
(2)步骤②中晶体应放在 _(填仪器名称)中灼烧,灼烧后得到的固体应为______ _____(填化学式)。
(3)步骤③所用的溶液可能是 ;
(4)步骤④主要包括:加入足量硝酸银溶液→ → → 晾干→称量;
(5)若组成符合通式,则可以计算x的物理量组合是 ____ (填序号)。
A.a、b B.a、c C.b、c D.a、b、c 缺一不可
23.(11分)硫代硫酸钠(Na2S2O3)可看成是一个S原子取代了Na2SO4中的一个O原子而形成。某校化学研究性学习小组运用类比学习的思想,通过实验探究Na2S2O3的化学性质。请填写以下空白:
[提出问题]Na2S2O3是否与Na2SO4相似具备下列性质呢?
猜想①: 。
猜想②:溶液呈中性,且不与酸反应。
猜想③:无还原性,不能被氧化剂氧化。
[实验探究]基于上述猜想②、③,设计实验方案。请填写下列表格中的(1)(2)(3)。
|
|
实验操作 |
实验现象或预期实验现象 |
现象解释 (用离子方程式表示) |
|
猜想② |
(1) |
溶液pH=8 |
--- |
|
向pH=2的硫酸中滴加Na2S2O3溶液 |
(2) |
S2O32-+2H+=S↓+SO2↑+H2O |
|
|
猜想③ |
向新制氯水(pH<2)中滴加少量Na2S2O3溶液 |
氯水颜色变浅 |
(3) |
[实验结论]Na2S2O3能与酸反应,具有还原性,与Na2SO4的化学性质不相似。
[问题讨论]
(1)甲同学向探究“猜想③”反应后的溶液中滴加硝酸银溶液,观察到有白色沉淀产生,并据此认为氯水可将Na2S2O3氧化。你认为该方案是否正确并说明理由 。
(2)请重新设计一个实验方案,证明Na2S2O3被氯水氧化。该实验方案是 。
22.(12分)明矾石是制取钾肥和氢氧化铝的重要原料,明矾石的组成和明矾相似,此外还含有氧化铝和少量氧化铁杂质。具体实验步骤如下图所示:

根据上述图示,完成下列填空:
⑴明矾石焙烧后用稀氨水浸出。配制500 mL稀氨水(每升含有39.20 g氨)需要取浓氨水(每升含有251.28 g氨)______mL,用规格为______mL量筒量取。
⑵氨水浸出后得到固液混合体系,过滤,滤液中除K+、SO42-外,还有大量的NH4+。
检验NH4+的方法是____________________________________________________ __。
⑶写出沉淀物中所有物质的化学式_____________________。
⑷滤液I的成分是水和________________。
⑸为测定混合肥料K2SO4、(NH4)2SO4中钾的含量,完善下列步骤:
①称取钾氮肥试样并溶于水,加入足量________溶液,产生白色沉淀。
②____ ___、_______、_______(依次填写实验操作名称)。
③冷却、称重。
⑹若试样为m g,沉淀的物质的量为 n mol,则试样中K2SO4的物质的量为:_ ___ mol(用含m、n的代数式表示)。
21.摩托罗拉公司研发了一种由甲醇、氧气以及强碱做电解质溶液的新型手机电池,容量达氢镍电池或锂电池的十倍,可连续使用一个月才充一次电。其电池反应为:
放电
2CH3OH+3O2+4OH-=======2CO32-+6H2O,
充电
则下列说法不正确的是 ( )
A.充电时,电能转化为化学能
B.充电时,电解质溶液的pH逐渐增大
C.放电时, CH3OH参与反应的电极为负极,发生还原反应
D.放电时,负极的电极反应为: CH3OH+8OH--6e= CO32-+6H2O
第II卷(非选择题,共87分)
20.等体积、等物质的量浓度的硫酸、氢氧化钠溶液分别放在甲、乙两烧杯中,各加等质量的铝,生成氢气的体积比为5:6,则甲、乙两烧杯中的反应情况可能分别是 ( )
A.甲、乙中都是铝过量 B.甲中铝过量、乙中碱过量
C.甲中酸过量、乙中铝过量 D.甲中酸过量、乙中碱过量
19.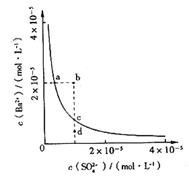 某温度时,BaSO4在水中的沉淀溶解平衡曲线如右图所示。
某温度时,BaSO4在水中的沉淀溶解平衡曲线如右图所示。
下列说法正确的是 ( )
A.a点对应的Ksp大于c点对应的Ksp
B.通过蒸发可以使溶液由d点变到c点
C.加入Na2SO4可以使溶液由a点变到b点
D.d点无BaSO4沉淀生成
18.下列实验过程中产生的现象与对应的图形符合的是 ( )
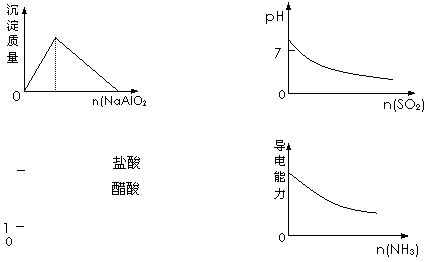
A.盐酸中加入NaAlO2溶液 B.SO2气体通入溴水中
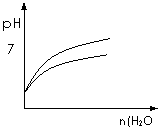
C.pH=1的醋酸与盐酸分别加水稀释 D.氨气通入醋酸溶液中
17.用铜做电极,电解某浓度的AgNO3和Cu(NO3)2的混合溶液,一段时间后,阴极上析出1.6gCu时,不考虑溶液体积变化,则下列叙述中正确的是
A.电路中流过0.05mol电子 B.溶液中c(Cu2+)降低
C.电解质溶液质量减少 D.阳极铜消耗了1.6g
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com