
17. T ℃时在2L刚性密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的浓度变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的体积百分含量与时间的关系如图2所示。则下列结论错误的是
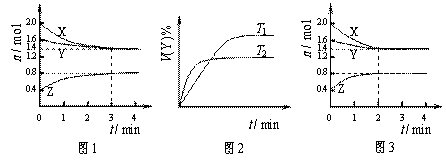

A.容器中发生的反应可表示为:3X(g)+Y(g) 2Z(g)
2Z(g)
B.保持其他条件不变,升高温度,平衡逆向移动
C.反应进行的前3min内,用X表示的反应速率 v(X)=0.1mol•L-1•min-1
D.若改变反应条件,使反应进程如图3所示,则改变的条件是使用催化剂
16. 在三个容积相同的容器①、②、③中均发生如下反应:3A(g)+B(g) 2C(g);△H<0。①容器容积固定,外有隔热套。②容器容积固定。③容器有活塞可移动。下列说法正确的是A
2C(g);△H<0。①容器容积固定,外有隔热套。②容器容积固定。③容器有活塞可移动。下列说法正确的是A
A.若起始温度相同,分别向三个容器中充入3molA和1molB,则达到平衡时各容器中C物质的百分含量由大到小的顺序为 ③>②>①
B.若维持温度不变,起始时②中投入3molA、1molB; ③中投入3molA、1molB和2molC,则达到平衡时,两容器中B的转化率②=③
C.若起始温度相同,分别向三个容器中充入1molA和1molB,则达到平衡时各容器中C物质的百分含量一定相同
D.若起始温度相同,分别向三个容器中充入3a molA和a molB,则达到平衡时各容器中A物质的转化率一定相同
15. 如右图所示,a、b是多孔石墨电极,某同学按图装置进行如下实验:断开K2,闭合K1一段时间,观察到两只玻璃管内都有气泡将电极包围,此时断开K1,闭合K2,观察到电流计A的指针有偏转。下列说法不正确的是
如右图所示,a、b是多孔石墨电极,某同学按图装置进行如下实验:断开K2,闭合K1一段时间,观察到两只玻璃管内都有气泡将电极包围,此时断开K1,闭合K2,观察到电流计A的指针有偏转。下列说法不正确的是
A.断开K2,闭合K1时,a极上的电极反应式为4OH--4e- =O2↑+2H2O
B.断开K2,闭合K1一段时间,溶液的pH要变大
C.断开K1,闭合K2时,b极上的电极反应式为:2H++2e- = H2↑
D.断开K1,闭合K2时,OH-向b极移动
14. 为达到预期的实验目的,下列操作正确的是
A.欲配制质量分数为10%的ZnSO4溶液,将l0 g ZnSO4·7H2O溶解在90 g水中
B.欲制备Fe(OH)3胶体,向盛有沸水的烧杯中滴加FeCl3饱和溶液并长时间煮沸
C.为鉴别KCl、AICl3和MgCl2溶液,分别向三种溶液中滴加NaOH溶液至过量
D.为减小中和滴定误差,锥形瓶必须洗净并烘干后才能使用
13. 下列实验装置、试剂选用或操作正确的是

A.除去NO中的NO2 B.铁制品表面镀锌
C.稀释浓硫酸 D.制备少量O2
12. 下列说法正确的是
A. SiO2和CO2中Si和O,C和O之间都是双键
B. 1个甘氨酸分子中存在9对共用电子
C. 除零主元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数
D. 某元素的一种同位素X的原子质量数为A,含N个中子,它与H原子组成HmX分子,在agHmX中所含质子的物质的量为(A-N+m) mol
11. 开发新材料是现代科技发展的方向之一。下列有关材料的说法不正确的是
A. 氮化硅陶瓷是新型无机非金属材料,可用来制造柴油机
B. 氧化铝陶瓷(人造刚玉)熔点高,可用作高级耐火材料
C. 纤维素乙酸酯属于天然高分子材料,可用于制造电影胶片的片基
D. 单晶硅常用于制造集成电路、太阳能电池和耐酸设备
10. 右表是元素周期表中短周期的一部分,已知A元素的原子中最外层电子数是其电子层数的3倍。下列关于表中六种元素的说法不正确的是
A.X元素形成的气态氢化物分子空间结构呈三角锥形
B.X、Y、Z三种元素形成的单核阴离子半径中Y最大
C.最高价氧化物对应的水化物酸性最强的是M元素
D.X的氢化物分子间存在氢键,因此X的熔沸点较高
9.
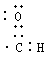 下列化学用语表达不正确的是
下列化学用语表达不正确的是

 A.CO2的分子比例模型图为: B.醛基的电子式:
A.CO2的分子比例模型图为: B.醛基的电子式:
C.光气COCl2的结构式: D.Cl-的离子的结构示意图:
|
X |
A |
M |
|
Y |
Z |
N |
8. 根据图示判断下列叙述符合事实的是
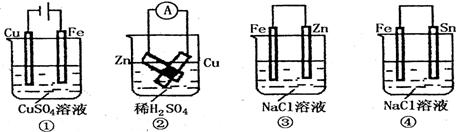
A.按图①连接并放置一段时间后,Fe片表面会“镀”上一层铜
B.按图②连接好导线后(Zn片与Cu片相接触),灵敏电流表会发生非常明显的偏转
C.按图③连接并放置片刻,在Fe片附近加一滴KSCN溶液,溶液变为深红色
D.按图④连接并放置一段时间后,在Sn片上有无色气泡聚集
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com