
27.(8分)常温下有浓度均为0.5mol/L的四种溶液:①NaHCO3;②C6H5ONa;③ NH4HCO3;④ NH3·H2O。
(1)常温下,①的pH大于8,则溶液中c(H2CO3) c(CO32-)(填“>”、“<”或“=”),原因是 。
(2)②的水溶液中各离子浓度由大到小的顺序是 。向FeCl3溶液中加入少量浓的②溶液,可能看到的现象是 。
(3)③跟足量的NaOH浓溶液在加热条件下反应的离子方程式是 。
(4)加热④,溶液中的c(OH-)的变化有甲乙两种猜想,请设计实验探究证明:
甲:c(OH-)将增大。升高温度有利于电离平衡移动,使氨水中c(OH-)增大。
乙:c(OH-)将减小。受热时温度升高氨气逸出,使c(OH-)减小
实验设计:
。
26.(8分)恒温、恒压下,在一个体积可变的容器甲中发生如下反应:2A(g)+B(g) 2C(g)(△H<0)
2C(g)(△H<0)
(1)若开始时充入4mol气体A和2mol气体B,一定温度下达到平衡状态时,测得气体总物质的量为4.2mol。则这时A的物质的量为 mol。
(2)若开始时充入6mol气体A和3mol气体B,达到平衡后,生成C的物质的量为
mol。
(3)若开始时充入xmol气体A、1mol气体B和3mol气体C,达到平衡后各组分体积分数与(1)相同,A和C的物质的量分别为ymol和4.5mol,则x= mol,y= mol。
(4)若在(3)的平衡混合物中再加入3mol气体C,待再次达到平衡后,C的体积分数为 。
(5)若维持温度不变,在一个与(1)反应前起始体积相同、且容积固定的容器乙中发生上述反应。开始时充入4mol气体A和2mol气体B,达到平衡后测得气体总物质的量为amol。则 (选填编号)
A. a<4.2 B. a>4.2 C. a=4.2 D.无法确定a和4.2的大小
(6)若使甲、乙容器内各物质的体积分数相同,可采取的措施是 。
A. 将甲容器升温 B. 将乙容器升温
C. 将甲容器降温 D. 将乙容器降温
25.(10分)按下图所示装置进行有关实验,将A逐滴加入B中:
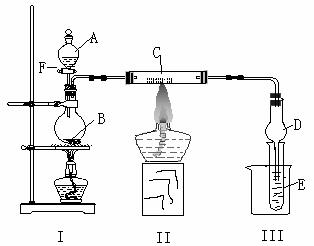
(1)若A是实验室的一种常用燃料,B是生石灰,实验中观察到C中黑色固体逐渐变红。当C中黑色固体大部分变红时关闭F,然后往烧杯中加入热水,静止一会,观察到Ⅲ中试管壁出现了光亮的银镜。请写出反应管C中所发生反应的化学方程式
。试管E中发生反应的离子方程式为
。仪器D在此实验中的作用是
。
(2)已知氨可以与灼热的氧化铜反应得到氮气和金属铜,用上图中的装置可以实现该反应。若I处酒精灯不加热,B、C仍是实验(1)中原物质,E中是某物质与葡萄糖的混合溶液。实验中也观察到C中黑色固体逐渐变红,同时可观察到E中溶液先形成沉淀,然后沉淀溶解,并有一种无色无味的气体逸出。当溶液恰好澄清时,关闭F,然后往烧杯中加入热水,静止一会,观察到III中试管壁也出现了光亮的银镜。则A是 ,E中是
(写化学式)与葡萄糖的混合液。请写出反应管C中所发生反应的方程式 ,B的作用是 。
(3)若I处酒精灯加热,并撤去装置Ⅱ:
|
试剂 |
乙醚 |
乙醇 |
乙酸 |
乙酸乙酯 |
|
沸点/℃ |
34.7 |
78.5 |
118 |
77.1 |
某课外小组设计用该装置制取乙酸乙酯。A为浓硫酸,B为乙醇、无水醋酸钠,E中盛饱和碳酸钠溶液。已知:无水氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH;②有关有机物的沸点如右表所示。则反应后E中的现象是 。从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出 ;再加入(填字母标号) ,然后进行蒸馏,收集77℃左右的馏分,以得较纯净的乙酸乙酯。
a.五氧化二磷 b.碱石灰 c.无水硫酸钠 d.生石灰
24.(10分)物质之间的转化关系如下图所示,A是黄色固体,可作为工业生产J的原料,B、C、H、I为非金属单质。常温下,D、X均为液态化合物,且X有强氧化性,能发生自身氧化还原。F为常见的红棕色防锈油漆颜料的主要成分,O是常见含氮量最高的氮肥,A、E、J、N中含有同一种元素。部分反应的部分反应物或产物未标出。请回答下列问题:
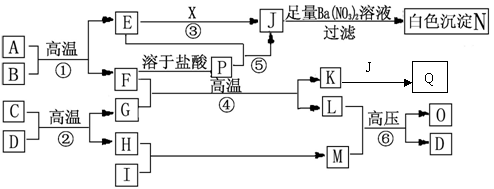

(1)X的结构式为 ,分子属于 (填“极性”或“非极性”);M分子的空间构型为 ,O的结构简式为 。
(2)实验室检验Q中阳离子的方法是 。
(3)写出下列反应的离子方程式:
⑤: ;
Q的溶液中加入NaClO溶液: ;
等物质的量的Q与Na2O2反应: ;
(4)A与足量的稀硝酸反应,A中各元素均被氧化成最高价态,写出该反应的化学方程式: 。
(5)在化工生产中,由A制J,现有100T质量分数为80℅的A参加反应,若几步反应总的转化率为80℅,则可生成98℅的J溶液 T(结果保留一位小数)。
23.(9分)现有部分短周期元素的性质或原子结构如下表:
|
元素编号 |
元素性质或原子结构 |
|
T |
单质能与水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 |
|
X |
最外层电子数是内层电子数的3倍 |
|
Y |
第三周期元素的简单离子中半径最小 |
|
Z |
T、X、Z组成的36电子的化合物A是家用消毒剂的主要成分 |
(1)元素T与X按原子个数比1:1形成的化合物B所含化学键为 ,该化合物的电子式为 。
(2)化合物A的溶液呈碱性,用离子方程式解释其原因: ,该化合物起消毒作用的微粒是 。
(3)将Y与Z形成的化合物的水溶液逐滴加入到T的最高价氧化物对应水化物的溶液中直至过量(边滴边振荡),写出此过程中发生反应的离子方程式
、 。
(4)在一定条件下,X、Y两种单质以及有多孔惰性电极在化合物TZ的水溶液中可形成原电池,为新型海水航标灯提供能源,写出该原电池正极的电极反应式
。若用该原电池电解X与Y形成的化合物,则阳极的电极反应式是 。当电解生成气体的体积为11.2L(标准状况)时,该原电池消耗的负极材料质量为 g。
22. 将51.2 g Cu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物共0.8 mol,这些气体恰好能被500 mL 2 mol/L NaOH溶液完全吸收,发生的反应为:2NO2+2NaOH=NaNO2+NaNO3+H2O、NO+NO2+2NaOH=2NaNO2+H2O。则生成的盐溶液中NaNO3的物质的量为
A. 0.2 mol B. 0.4 mol C. 0.6 mol D. 0.8 mol
第Ⅱ卷 非选择题(共56分)
21. 将物质的量均为a mol的钠和铝一同投入m g水中(水足量),所得溶液的密度为ρg·cm-3,则此溶液的物质的量浓度为
A.mol/L B.mol/L C.mol/L D.mol/L
20. 已知:常温下醋酸铵溶液的pH=7。现有常温下的4组混合溶液,分别由等体积0.1mol/L的2种溶液混合而成:①NH4Cl与NaOH;②NH4Cl与HCl;③NH4Cl与NaCl;④NH4Cl与NaHCO3,下列各项正确的是
A.pH大小顺序:①>④>③>② B. c(NH3·H2O)大小顺序:②>④>③>①
C. 混合液④中存在:c(NH3·H2O)+c(CO32-)+ c(H+)=c(OH-)+ c(H2CO3)
D. 混合液④中存在:c(NH4+)<c(HCO3-)+ 2c(CO32-)
19. 关于浓度均为0.1 mol/L的三种溶液:①氨水、②盐酸、③氯化铵溶液,下列说法不正确的是
A.c(NH4+):③>①
B.水电离出的c(H+):②>①
C.①和②等体积混合后的溶液:c(H+)=c(OH-)+c(NH3·H2O)
D.①和③等体积混合后的溶液:c(NH4+)>c(Cl-)>c(OH-)>c(H+)
18.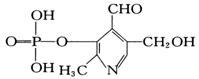 磷酸毗醛素是细胞的重要组成部分,可视为由磷酸形成的酯,其结构式如下图,下列有关叙述正确的是
磷酸毗醛素是细胞的重要组成部分,可视为由磷酸形成的酯,其结构式如下图,下列有关叙述正确的是
A.该物质的分子式为C8H9O6NP
B.该物质能与金属钠反应,能发生银镜反应,还
能使石蕊试液变红
C.该物质为芳香族化合物
D.1mol该物质与NaOH溶液反应,最多消耗3mol NaOH
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com