
7.NA表示阿伏伽德罗常数,下列说法不正确的是
A.10g重水(D2O)中含有5NA个中子
B.N60分子中每个N原子均达到8电子稳定结构,则28gN60分子中含有共用电子对3NA个
C.标准状况下,15gNO和16gO2混合气体的体积约为22.4L
D.64gCaC2晶体中所含阴离子总个数为2NA
6.背景新闻:①2009年4月,德国NUK婴儿爽身粉因含致癌物“滑石粉”(Mg3(Si4O10)(OH)2)引起关注。②2010年1月12日海地首都太子港发生7.3级地震,急需大量医药品、食物、饮用水等。③2009年12月下旬,渤海、黄海海域出现严重的海冰灾害。④2009年诺贝尔化学奖成果与蛋白质知识有关。下列说法不正确的是
A.滑石粉属于无机硅酸盐类物质,滑石粉的组成可表示为3MgO·4SiO2·2H2O
B.次氯酸钠、石灰、明矾可作消毒杀菌剂;碳酸钡俗称“钡餐”,是一种医疗药品
C.水结冰时体积膨胀,密度减小,是因为水分子大范围以氢键相连,形成疏松晶体
D.毛、发等的主要成分都是蛋白质,蛋白质水解的最终产物是氨基酸
5.我国首例绿色荧光蛋白转基因克隆猪在东北农业大学的种猪场自然分娩产出,这标志着我国在转基因克隆猪技术领域已达到世界领先水平。下图为我国首例绿色荧光蛋白转基因克隆猪的培育过程示意图。下列说法正确的是

A.水母的基因和猪的基因在结构上不相同
B.该过程运用到了基因工程、细胞工程等技术手段
C.早期胚胎的培养液成分较复杂,除一些无机盐和有机盐类外,还需添加维生素、生长素、蔗糖等物质
D.转基因猪的性状与受体母猪相同
4.掌握微生物群体的生长规律,目的是更好地研究和利用它们。下列说法不正确的是
|
A.在配制培养菌种和发酵过程中的培养基时,尽可能保持它们的成分相似,以利于缩短调整期 B.生产上常常用对数期的细菌做菌种 C.连续培养法延长了培养周期,从而提高总产量 D.在稳定期中适当补充营养物质有利于提高产量 |
3.美国一家生物制药实验室正在研制一种戒烟疫苗,目前已进入最后阶段。注射疫苗后,人体会产生尼古丁抗体。免疫系统一旦觉察到尼古丁,便会立即采取行动,使抗体与尼古丁分子结合,以阻止其进入大脑而引起脑神经兴奋。目前尚未发现这种疫苗有明显副作用。疫苗植入体内可望保持半年至一年的有效期。下列说法不正确的是
|
A.戒烟疫苗属于抗原 B.尼古丁抗体与抗毒素的组成单位相同 C.能够产生尼古丁抗体是效应B细胞,其细胞内的DNA、RNA、与T细胞的不同 D.疫苗植入体内的有效期与记忆细胞存在的时间长短密切相关 |
2.图甲是某生物的一对同源染色体的基因分布图(a+与a、b+与b、c+与c依次类推为等位基因),图乙是该对同源染色体的姐妹染色单体分离后形成的四条染色体的基因分布图。下列说法正确的是
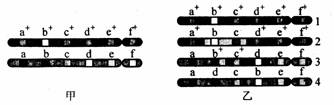
|
A.该生物因交叉互换而发生了染色体的结构变异 B.1和3、2和4为原来的姐妹染色单体分离后形成的两个子染色体 C.该对同源染色体的非姐妹染色单体在减数第一次分裂的四分体时期发生了交叉互换 D.该变化改变了基因在染色体上的排列次序 |
1. 下列各项分别表示一组概念的从属关系,其中不正确的是

6、无机化合物及其应用
①理解并能应用常见金属的活动顺序。(对照金属活动性顺序表)
写出金属活动性顺序表:
以及由此延伸的金属离子活动性顺序表(注意不同状况下H+及Fe3+的排序):
[研究题41]A、B、C、D、E分别是Cu、Ag、Fe、Al、Mg五种金属中的一种。已知:①A、C均能与稀硫酸反应放出气体;②B与D的硝酸盐反应,置换出单质D; ③C、E 在冷浓硫酸中发生钝化。由此可判断A、B、C、D、E依次为 ( )
A.Fe、Cu、Al、Ag、Mg B.Al、Cu、Mg、Ag、Fe
C.Mg、Cu、Al、Ag、Fe D.Mg、Ag、Al、Cu、Fe
②P42~58 了解常见金属(如Na、Al、Fe、Cu等)及其重要化合物的主要性质和重要应用。
钠的主要化学性质:
钠的主要化合物及性质:
“铝三角”:
“铁三角”:
铜的主要化合物及颜色:
铜的化合物的化学性质及相互转化:
 [研究题42](06上海)已知Ba(AlO2)2可溶于水。右图表示的是向A12(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加人Ba(OH)2的物质的量x的关系。下列有关叙述正确的是( )
[研究题42](06上海)已知Ba(AlO2)2可溶于水。右图表示的是向A12(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加人Ba(OH)2的物质的量x的关系。下列有关叙述正确的是( )
A.a-b时沉淀的物质的量:A1(OH)3比BaSO4多
B.c-d时溶液中离子的物质的量:AlO2-比Ba2+多
C.a-d时沉淀的物质的量:BaSO4可能小于A1(OH)3
D.d-e时溶液中离子的物质的量:Ba2+可能等于OH-
[研究题43](1)物质X是中学化学中的常见物质,X既能与稀硫酸反应,又能与氢氧化钠溶液反应。
① 若X为氧化物,X的化学式是____________。
② 若X为单质,X用于焊接钢轨反应的化学方程式是_____________。
③ 若X与稀硫酸反应生成无色无味的气体A,与浓氢氧化钠溶液加热反应生成气体B。等物质的量的A和B在水溶液中反应又生成X。
X与稀硫酸反应的离子方程式是 ;
X与足量稀氢氧化钠溶液反应的离子方程式是 。
(2)在宇航器中,可以不断的将座舱内的空气通过盛有金属过氧化物(以过氧化钠为例)的容器,以除去A。反应的化学方程式是 。
科学家设计出新的航天飞船内的空气更新系统。其中一步是A和氢气在200℃~250℃时,镍催化剂作用下,生成甲烷和另一种物质。该反应的化学方程式是________ ____。
③P68~96 了解常见非金属(如H、C、N、O、S、Si、Cl等)及其化合物的主要性质和重要应用。
过氧化氢的性质:
二氧化硫的化学性质:
浓硫酸的特性并各举一例
硅的物理性质和应用
二氧化硅的俗称和应用
二氧化硅的化学性质
硝酸酸性的表现
硝酸强氧化性的表现
什么是“钝化”并举例
氨气的化学性质
铵盐的化学性质
氨气的检验方法
实验室制备氨气的方法
[研究题44].(08广东卷)下列有关Cl、N、S等非金属元素化合物的说法正确的是( )
A.漂白粉的成分为次氯酸钙 B.实验室可用浓硫酸干燥氨气
C.实验室可用NaOH溶液处理NO2和HCl废气
D.Al2(SO4)3可除去碱性废水及酸性废水中的悬浮颗粒
[研究题45].(08重庆卷)下列叙述正确的是( )
A.稀硝酸、稀硫酸均能将木炭氧化成二氧化碳
B.Na2O2与水反应,红热的Fe与水蒸气反应均能生成碱
C.Li、C、P分别在足量氧气中燃烧均生成一种相应氧化物
D.NaHCO3、Na2CO3、(NH4)2CO3三种固体受热后均能生成气体
[研究题46].(08上海卷)如图所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质压到甲针筒内,进行下表所列的不同实验(气体在同温同压下测定)。试回答下列问题:


(1)实验1中,沉淀最终变为________色,写出沉淀变色的化学方程式_______________________________。
(2)实验2甲针筒内的现象是:有___________生成,活塞________移动(填向外、向内、不)。反应后甲针筒内有少量的残留气体,正确的处理方法是将其通入___________溶液中。
(3)实验3中,甲中的3mL气体是NO2和N2O4的混合气体,那么甲中最后剩余的无色气体是_______,写出NO2与H2O反应的化学方程式为_______________________________。
(4)实验4中,已知:3Cl2+2NH3=N2+6HCl。甲针筒出活塞有移动,针筒内有白烟产生外,气体的颜色变为____________。最后针筒内剩余气体的体积约为________mL。
④必修二P82~ 87 认识化学在海水、金属矿物等自然资源综合利用方面的重要作用。 [研究题47](2007 广东4)许多国家十分重视海水资源的综合利用。不需要化学变化就能够从海水中获得的物质是( )
A.氯、溴、碘 B.钠、镁、铝 C.烧碱、氢气 D.食盐、淡水
 [研究题48](2007 江苏20)右图中各物质均由常见元素(原子
[研究题48](2007 江苏20)右图中各物质均由常见元素(原子
序数≤20)组成。已知A、B、K为单质,且在常温下A和K为气体,B为固体。D为常见的无色液体。I是一种常用的化肥,在其水溶液中滴加AgNO3溶液有不溶于稀HNO3的白色沉淀产生。J是一种实验室常用的干燥剂。它们的相互转化关系如右图所示(图中反应条件未列出)。请回答下列问题:
⑴I的化学式为 ;J的电子式为 。
⑵反应①的化学方程式为 。
⑶F的水溶液与氯气反应的离子方程式为 。
⑤P60~ 63了解金属材料在生产和生活中的重要应用。认识常见无机物在生产中的应用和对生态环境的影响。
[研究题49](2006 天津理综)引起下列环境污染的原因不正确的是( )
A.重金属、农药和难分解有机物等会造成水体污染
B.装饰材料中的甲醛、芳香烃及氡等会造成居室污染
C.SO2、NO2或CO2都会导致酸雨的形成
D.CO2和氟氯烃等物质的大量排放会造成温室效应的加剧
[研究题50](2007 山东理综28)二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要
 污染物。综合治理其污染是环境化学当前的重要研究内容之一。
污染物。综合治理其污染是环境化学当前的重要研究内容之一。
⑴硫酸生产中,SO2催化氧化生成SO3:
 2SO2(g)+O2(g) 2SO3(g)
2SO2(g)+O2(g) 2SO3(g)
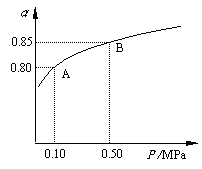
某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如右图所示。根据图示回答下列问题:
①将2.0 mol SO2和1.0 mol O2置于10 L密闭容器中,反应达平衡后,体系总压强为0.10 MPa。该反应的平衡常数等于 。
②平衡状态由A变到B时,平衡常数K(A) K(B)(填“>”、“<”或“=”)。
⑵用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160 kJ·mol-1
若用标准状况下4.48 L CH4还原NO2至N2,整个过程中转移的电子总数为 (阿伏加德罗常数的值用NA表示),放出的热量为 kJ。
⑶新型纳米材料氧缺位铁酸盐(MFe2Ox 3<x<4,M=Mn、Co、Zn或Ni)由铁酸盐(MFe2O4)经高温还原而得,常温下,它能使工业废气中的酸性氧化物分解除去。转化流程如图所示:

请写出MFe2Ox分解SO2的化学方程式 (不必配平)。
23.[必做题]已知抛物线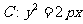 ,直线
,直线 与抛物线C交于点A,B,与
与抛物线C交于点A,B,与 轴交于点M.
轴交于点M.
(1)若抛物线焦点坐标为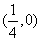 ,求直线
,求直线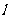 与抛物线C围成的面积;
与抛物线C围成的面积;
(2)直线 与抛物线C交于异于原点的点P,MP交抛物线C于另一点Q,求证:当
与抛物线C交于异于原点的点P,MP交抛物线C于另一点Q,求证:当 变化时,点Q在一条定直线上.
变化时,点Q在一条定直线上.
宿迁市2010年高三年级模拟试卷(三)
22.[必做题]一投掷飞碟的游戏中,飞碟投入红袋记2分,投入蓝袋记1分,未投入袋记0分.经过多次试验,某人投掷100个飞碟有50个入红袋,25个入蓝袋,其余不能入袋.
(1)求该人在4次投掷中恰有三次投入红袋的概率;
(2)求该人两次投掷后得分 的数学期望
的数学期望 .
.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com