
17.如同“pH为溶液中的c(H+)的负对数”一样,“pOH则是溶液中c(OH-)的负对数”。在下列所表示的溶液中,一定呈中性的是
A.由等体积、等物质的量浓度的一元酸跟氢氧化钠溶液混合所形成的溶液
B.c(H+ )== 1×10-7mol·L-1的溶液
C.pH == 14-pOH的溶液
D.pH == pOH的溶液
16.在相同温度时,100 mL 0.01mol/L的醋酸溶液与10 mL 0.1mol/L的醋酸溶液相比较,下列数值前者大于后者的是
A.中和时所需NaOH的量 B. 电离程度
C.H+的物质的量浓度 D.CH3COOH的物质的量
15.pH=1的两种一元酸HX和HY的溶液,分别取50mL,加入足量的镁粉,充分反应
收集的氢气的体积分别为V(HX)和V(HY),若V(HX)>V(HY),下列说法正确的是
A.HX一定是弱酸 B.HY一定是强酸
C.HX的酸性强于HY的酸性 D.反应开始时二者生成H2的速率不相同
14.已知醋酸达到电离平衡后,改变某条件使平衡向正反应方向移动,则下列说法正确的是
A.醋酸的电离度一定变大 B.发生电离的分子总数增大
C.溶液的pH一定减小 D.溶液的导电能力一定变强
13.下物质分类组合正确的是
|
|
A |
B |
C |
D |
|
强电解质 |
HBr |
FeCl3 |
H3PO4 |
Ca(OH)2 |
|
弱电解质 |
HF |
HCOOH |
BaSO4 |
HI |
|
非电解质 |
NH3 |
Cu |
H2O |
C2H5OH |
12.2008年是勒夏特列(1850-1936)诞辰158周年,他发现的平衡移动原理在工、农业生产和日常生活中有许多重要应用。下列事实中,能用勒夏特列原理解释的是
A.向氯水中加食盐不利于氯气的溶解
B.由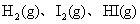 组成的平衡体系,加压后颜色加深
组成的平衡体系,加压后颜色加深
C.SO2催化氧化成SO3的反应,往往需要使用催化剂
D.500℃左右比室温更有利于合成氨的反应
11.在一定温度下体积固定的密闭容器中,当下列物理量不再变化时,能表明可逆反应A(s)+2B(g) 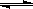 C(g)+D(g)已达平衡的是
C(g)+D(g)已达平衡的是
①混合气体的压强 ②气体的总物质的量 ③混合气体的密度 ④C的物质的量浓度 A.①② B.③④ C.①④ D.只有④
10.下列说法正确的是
A.增大反应物浓度,可增大活化分子的百分数,从而使有效碰撞次数增大
B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大
C.升高温度能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数
D.催化剂不影响反应活化能,但能增大单位体积内活化分子百分数,从而增大反应速率
9.下列说法不正确的是
A.焓变是一个反应能否自发进行相关的因素,多数放热反应能自发进行
B.自发进行的反应一定能迅速进行
C.在同一条件下不同物质有不同的熵值,其体系的混乱程度越大,熵值越大
D.一个反应能否自发进行,与焓变和熵变的共同影响有关
8.体积比为2∶3的N2和H2的混合气体,在一定条件下发生反应。达到平衡时,容器内压强为反应开始时的4/5,则N2的转化率为
A.50% B.37.5% C.25% D.12.5%
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com