
27.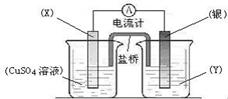 (7分)依据氧化还原反应2Ag+(aq)
+ Cu(s) = Cu2+(aq) + 2Ag(s)设计的原电池如图所示。请回答下列问题:
(7分)依据氧化还原反应2Ag+(aq)
+ Cu(s) = Cu2+(aq) + 2Ag(s)设计的原电池如图所示。请回答下列问题:
(1)电极X的材料是_ ▲ ,电解质溶液Y是
_ ▲ ;
(2)银电极为电池的_ ▲ 极,发生的电极反应式为_ ▲ ,X电极上发生的电极反应式为_ ▲ ;
(3)外电路中的电子是从_ ▲ 电极流向_ ▲ 电极(填电极材料名称)。
26.(6分 )将化学知识的系统化,有助于对化学问题的进一步认识。请你参与下列关于化学反应的讨论。
问题1:1840年盖斯根据一系列实验事实得出规律:“若是一个反应可以分步进行,则各步反应的反应热总和与这个反应一次发生时的反应热相同。”这是在各反应于相同条件下完成时的有关反应热的重要规律。已知:
①P4(s,白磷)+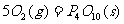
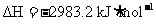
②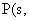 红磷
红磷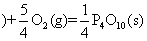
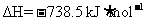
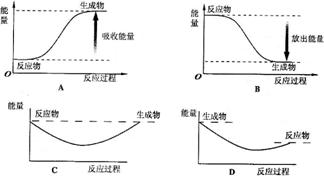 写出白磷转化为红磷的热化学方程式_ ▲ 。则对应下列化学反应过程中的能量变化图,能正确反映出由白磷转化为红磷的是_
▲ (填序号);
写出白磷转化为红磷的热化学方程式_ ▲ 。则对应下列化学反应过程中的能量变化图,能正确反映出由白磷转化为红磷的是_
▲ (填序号);
问题2:化学变化过程中的平衡状态可以通过改变反应条件而发生变化。对化学平衡、电离平衡等各种平衡移动的方向与外界条件变化的关系请你运用一句话进行总结_ ▲ 。
25.用石墨电极电解100 mL H2SO4与CuSO4的混合溶液,通电一段时间后,两极均收集到2.24 L气体(标准状况),则原混合溶液中Cu2+的物质的量浓度为
A.1 mol·L-1 B.2 mol·L-1 C.3 mol·L-1 D.4 mol·L-1
第II卷(非选择题,共70分)
24.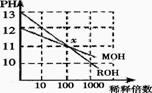 MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如下图所示。下列叙述中不正确的是:
MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如下图所示。下列叙述中不正确的是:
A.ROH是一种强碱
B.在x点,MOH并没有完全电离
C.在x点,c(M+)=c(R+)
D.稀释前,c(ROH)=10c(MOH)
23.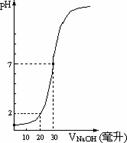 有10毫升一定物质的量浓度的盐酸X,用一定物质量浓度的NaOH溶液Y滴定,根据右图推出NaOH溶液和盐酸的物质量的浓度正确的是
有10毫升一定物质的量浓度的盐酸X,用一定物质量浓度的NaOH溶液Y滴定,根据右图推出NaOH溶液和盐酸的物质量的浓度正确的是
|
|
A |
B |
C |
D |
|
C(HCl)(mol/L) |
0.12 |
0.04 |
0.12 |
0.09 |
|
C(NaOH)(mol/L) |
0.04 |
0.12 |
0.06 |
0.03 |
22.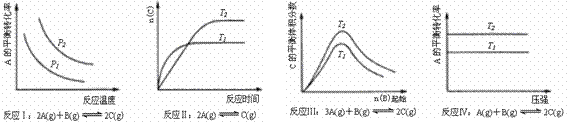 某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如图所示变化规律(图中P表示压强,T表示温度,n表示物质的量),根据图示变化规律判断,下列结论正确的是
某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如图所示变化规律(图中P表示压强,T表示温度,n表示物质的量),根据图示变化规律判断,下列结论正确的是
A.反应Ⅰ:△H<0,P2>P1 B.反应Ⅱ:△H>0,T1>T2
C.反应Ⅲ:△H<0,T2>T1;或△H>0,T2<T1 D.反应Ⅳ:△H<0,T2>T1
21.将1mol SO2和1mol O2,通入一个体积不变的密闭容器中,在一定温度和催化剂作用下反应达到平衡,SO3为0.3mol,此时移走0.5mol O2和0.5mol SO2,则反应达到新的平衡时,SO3的物质的量是
A.0.3mol B.0.15mol C.小于0.15mol D.大于0.15mo,小于0.3mol
20.液氨与水的电离相似,存在着微弱的电离:2NH3  NH4++ NH2-。对该体系的说
NH4++ NH2-。对该体系的说
法中错误的是
A.一定温度下,液氨中c(NH4+)与c(NH2-)的乘积为一常数
B.液氨的电离达到平衡时,c(NH3) = c(NH2-) = c(NH4+)
C.只要不加入其他物质,液氨中c(NH4+)总是与c(NH2-)相等
D.液氨中含有NH3、NH4+和NH2-等微粒
19.一定量的盐酸跟过量的铁粉反应时,为了减缓反应速度,且不影响生成氢气的总量,可向盐酸中加入适量的
①NaOH固体;②H2O;③NH4Cl固体;④CH3COONa固体 ⑤NaNO3固体;⑥KCl溶液。
A. ①② B. ②③⑤ C. ②④⑥ D.②④⑤⑥
18.H+浓度相同的等体积的两份溶液A和B,A为盐酸,B为醋酸,分别和锌反应,若最后仅有一份溶液中存在锌,且放出氢气的质量相同,则下列说法正确的是
①反应所需要的时间B>A ②开始反应时的速率A>B ③参加反应的锌的物质的量A=B
④反应过程的平均速率B>A ⑤盐酸里有锌剩余 ⑥醋酸里有锌剩余
A.③④⑥ B.②③⑥ C.③④⑤ D.①②⑤
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com