
26.(6分) 问题1: ,白磷)===4P(s,红磷)
,白磷)===4P(s,红磷) 
问题2:改变影响平衡的一个条件。平衡将向能够减弱这种改变的方向移动。
第II卷(非选择题,共70分)
35.(6分)常温下,将0.05 mol·L-1的盐酸溶液和未知浓度的氢氧化钠溶液以1∶2的体积比混合,可得到混合液的pH为12,用上述氢氧化钠溶液滴定pH为3的某一元弱酸(HA)20mL,达到终点时消耗氢氧化钠溶液12.5mL。试求:
(1)氢氧化钠溶液的物质的量浓度;
(2)此一元弱酸(HA)的物质的量浓度;
(3)此温度下一元弱酸(HA)的Ka。
杭七中2009-2010学年下学期
高二化学期中模拟试卷评分标准(理)
第I卷(选择题,共50 分)
34. (6分)已知:某温度下,向容积为2L的恒容密闭容器中加入2 mol X和2 mol Y,发生反应X(g)+Y(g)
(6分)已知:某温度下,向容积为2L的恒容密闭容器中加入2 mol X和2 mol Y,发生反应X(g)+Y(g)  2Z(g)。在1min时反应达到平衡,混合气体中Z的体积分数[
2Z(g)。在1min时反应达到平衡,混合气体中Z的体积分数[ ]随时间(t)变化曲线如下图所示,在2min时再向此容器中加入2 mol Z,在3min时反应重新达到平衡至4min。
]随时间(t)变化曲线如下图所示,在2min时再向此容器中加入2 mol Z,在3min时反应重新达到平衡至4min。 求:
求:
(1)该反应在前1min内用X表示的 平均速率。
平均速率。
 (2)该温度下的平衡常数。
(2)该温度下的平衡常数。
 (3)请在右图中将0-4min的变化曲
(3)请在右图中将0-4min的变化曲 线图补充完
线图补充完
整(必须注明图中纵坐标的对应数值)。
33.(10分)Ⅰ.实验室为测定一新配制的稀盐酸的准确浓度,通常用纯净的无水Na2CO3固体配成标准溶液滴定。具体操作是:称取wg纯净的无水Na2CO3固体装入锥形瓶中,加适量蒸馏水溶解,在酸式滴定管中加入待测盐酸滴定。
(1)锥形瓶中应加入几滴指示剂,由于CO2溶解在溶液中会影响pH,从准确性考虑,滴定终点宜选在pH为4-5之间,那么酸碱指示剂宜选_ ▲ ,当滴定至溶液由
▲ 色变成_ ▲ 色时,即表示到达终点;
(2)若滴定到终点时,消耗盐酸的体积为VmL,则盐酸的物质的量浓度为_ ▲ mol/L。
Ⅱ.用中和滴定法测定烧碱的纯度,若烧碱中不含有与酸反应的杂质,试根据实验回答:
(1)准确称取烧碱样品5.0g,将样品配成250mL的待测液。
(2)取10.00mL待测液,用_ ▲ 量取注入锥形瓶中。(填仪器名称)
(3)用0.2000mol/L标准盐酸溶液滴定待测烧碱溶液,滴定时左手_ ▲ ,右手
_ ▲ ,两眼注视 _ ▲ ,直到滴定终点。
(4)根据下列测定数据,分析得到合理数据,计算待测烧碱溶液的浓度为_ ▲ 。
|
滴定次数 |
待测液体积/mL |
标准盐酸体积/mL |
|
|
滴定前读数(mL) |
滴定后读数(mL) |
||
|
第一次 |
10.00 |
0.50 |
20.40 |
|
第二次 |
10.00 |
4.00 |
24.10 |
|
第三次 |
10.00 |
4.20 |
25.70 |
(5)该烧碱样品的纯度为_ ▲ 。
32. (7分)已知Co(H2O)62+显粉红色,CoCl42-显蓝色。CoCl2晶体在不同的盐酸溶液中会显示不同的颜色:①在很稀的盐酸中呈粉红色;②在浓盐酸中呈蓝色;③在一定浓度的盐酸中会呈紫色。
(7分)已知Co(H2O)62+显粉红色,CoCl42-显蓝色。CoCl2晶体在不同的盐酸溶液中会显示不同的颜色:①在很稀的盐酸中呈粉红色;②在浓盐酸中呈蓝色;③在一定浓度的盐酸中会呈紫色。





 (1)某同学将一定量的氯化钴晶体溶于浓盐酸中,然后在该溶液中加入大量水,溶液的颜色如何变化?_ ▲ ,其原因为_ ▲ 。(请用相关的离子方程式和适当的文字进行说明)。写出对应平衡的平衡常数表达式K=_ ▲ ;
(1)某同学将一定量的氯化钴晶体溶于浓盐酸中,然后在该溶液中加入大量水,溶液的颜色如何变化?_ ▲ ,其原因为_ ▲ 。(请用相关的离子方程式和适当的文字进行说明)。写出对应平衡的平衡常数表达式K=_ ▲ ;
 (2)某同学将盛有③获得的溶液的试管置于热水中,溶液变为蓝色,则说明该平衡的ΔH
(2)某同学将盛有③获得的溶液的试管置于热水中,溶液变为蓝色,则说明该平衡的ΔH
 _ ▲ 0(填“<”、“>”或“=”),此时,平衡常数K_ ▲ (填“变大”、“变小”或“不变”)。
_ ▲ 0(填“<”、“>”或“=”),此时,平衡常数K_ ▲ (填“变大”、“变小”或“不变”)。
31.(9分)某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、碎泡沫塑料板、胶头滴管、环形玻璃搅拌棒、0.5mol· L-1 盐酸0.55mol· L-1NaOH溶液,尚缺少的实验玻璃用品是
_ ▲ 、_ ▲ ;
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒?_ ▲ (填“能”或“否”),其原因是_ ▲ ;
(3)他们记录的实验数据如下:
|
实 验 用 品 |
溶 液 温 度 |
中和热 △H |
|||
|
t1 |
t2 |
||||
|
① |
50mL0.55mol.L-1NaOH |
50mL.0.5mol.L-1HCl |
20℃ |
23.3℃ |
▲ |
|
② |
50mL0.55mol.L-1NaOH |
50mL.0.5mol.L-1HCl |
20℃ |
23.5℃ |
已知:Q=Cm(t2 -t1),反应后溶液的比热容C为4.18KJ·℃-1· Kg-1,各物质的密度均为1g·cm-3。
①计算完成上表。
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式_ ▲ ;
(4)如果用50 mL 0.55 mol·L-1的氨水(NH3·H2O)代替NaOH溶液进行上述实验,通过测得的反应热计算中和热,其中和热△H会偏大,其原因是_ ▲ 。
30.(5分)有pH=2的盐酸、硫酸、醋酸三瓶溶液:(以下用“>”、“<”或“=”表示)
(1)设这三种酸溶液的物质的量浓度依次为C1、C2、C3(mol/L),则其关系是 _ ▲ ;
(2)取相同体积的三种酸分别加入蒸馏水稀释到pH=4,需水的体积依次为V1、V2、V3,则其关系是_ ▲ ;
(3)完全中和体积与物质的量浓度均相同的Ba(OH)2溶液时,需三种酸的物质的量依次为n1、n2、n3,则其关系是_ ▲ ;
(4)取相同体积的三种酸溶液分别加入足量的锌粉,反应开始放出H2的速率依次为υ1、υ2、υ3,则其关系是_ ▲ ;反应过程中放出H2的速率依次为υa、υb、υc,则其关系是_ ▲ 。
29. (6分)水的电离平衡曲线如下图所示:
(6分)水的电离平衡曲线如下图所示:
(1)若以A点表示25℃时水在电离平衡时的离子浓度, 当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积从_ ▲ 增加到_ ▲ ;
(2)在100℃时,将pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,并保持100℃的恒温,欲使混合溶液pH=7,则
Ba(OH)2与盐酸的体积比为_ ▲ ;
(3)已知AnBm的离子积=[c(Am+)]n·[c(Bn-)]m?,式中c(Am+)和c(Bn-)表示离子的物质的量浓度。在某温度下,Ca(OH)2的溶解度为0.74 g,其饱和溶液密度设为1 g/mL,其离子积为_ ▲ 。
28.(8分)现有反应:mA(g)+nB(g) pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,试回答下列问题:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,试回答下列问题:
(1)该反应的逆反应为_ ▲ 热反应,且m+n_ ▲ p(填“>”、“=”或“<”);
(2)加压时,混合物的平均相对分子质量_ ▲ (填“增大”、“减小”或“不变”,下同);
(3))若加入B(保持体系体积不变),则A的转化率_ ▲ ,B的转化率_ ▲ ;
(4)若升高温度,则平衡时B、C的浓度之比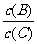 将_ ▲ ;
将_ ▲ ;
(5)若B是有色物质,A、C均无色,则加入C(保持体系体积不变)时混合物颜色_ ▲ ;
而维持容器内压强不变充入氖气时,混合物颜色_ ▲ (填“变深”、“变浅”或“不变”)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com