
1.下列物质不能为人类生命活动提供能量的是
A.米饭 B.水 C.鸡蛋 D.花生油
60.已知碳酸钙分解的热化学方程式为 CaCO3(s)=CaO(s)+CO2(g);
CaCO3(s)=CaO(s)+CO2(g);  H=+178.5KJ·mol-1
H=+178.5KJ·mol-1
 (1)欲使2
t CaCO3完全分解,最少需要提供多少热量? 。
(1)欲使2
t CaCO3完全分解,最少需要提供多少热量? 。
 (2) 已知煤炭的热值为33KJ·g-1,请写出炭完全燃烧生成CO2时的热化学方程式,并计算若通过煤炭燃烧提供热量,则至少需要燃烧煤炭多少千克?
(2) 已知煤炭的热值为33KJ·g-1,请写出炭完全燃烧生成CO2时的热化学方程式,并计算若通过煤炭燃烧提供热量,则至少需要燃烧煤炭多少千克?

北师大南湖附校高一第二学期期末复习专题二练习
59.某温度下,向10L真空容器中注入1.00mol H2(g) 和1.00mol I2(g),反应平衡后碘的浓度为0.0200mol/L。
(1)试求:该温度下H2(g) + I2(g)  2HI(g) 的H2的平衡转化率。
2HI(g) 的H2的平衡转化率。
(2)若开始加入2.00mol H2(g) 和I2(g),试求达到平衡时生成HI的物质的量。
58.氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:
 依据上图,完成下列填空:
(1)在电解过程中,与电源正极相连的电极上所发生反应的化学方程式为 ,与电源负极相连的电极附近,溶液pH值 (选填:不变、升高或下降)
(2)工业食盐含Ca2+、Mg2+等杂质。精制过程发生反应的离子方程式为 ,
(3)如果粗盐中SO42-含量较高,必须添加钡式剂除去SO42-,该钡试剂可以是 (选填a、b、c,多选扣分)
a Ba(OH)2 b Ba(NO3)2 C BaCl2
(4)为有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为 (选填a,b,c多选扣分)
a 先加NaOH,后加Na2CO3,再加钡试剂 b 先加NaOH,后加钡试剂,再加Na2CO3
依据上图,完成下列填空:
(1)在电解过程中,与电源正极相连的电极上所发生反应的化学方程式为 ,与电源负极相连的电极附近,溶液pH值 (选填:不变、升高或下降)
(2)工业食盐含Ca2+、Mg2+等杂质。精制过程发生反应的离子方程式为 ,
(3)如果粗盐中SO42-含量较高,必须添加钡式剂除去SO42-,该钡试剂可以是 (选填a、b、c,多选扣分)
a Ba(OH)2 b Ba(NO3)2 C BaCl2
(4)为有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为 (选填a,b,c多选扣分)
a 先加NaOH,后加Na2CO3,再加钡试剂 b 先加NaOH,后加钡试剂,再加Na2CO3
c 先加钡试剂,后加NaOH,再加Na2CO3
(5)脱盐工序中利用NaoH和NaCl在溶解度上的差异,通过 、冷却、 (填写操作名称)除去NaCl (6)在隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2与NaOH反应;采用无隔膜电解冷的食盐水时,Cl2与NaOH充分接触,产物仅是NaClO和H2,相应的化学方程式为
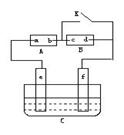
57.如图A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,.发现B上的c点显红色,请填空: (1)电源A上的a为______________极 (2)滤纸B上发生的总化学方程式为:________________________________ (3)欲在电镀槽中实现铁上镀锌,接通K点,使c、d两点短路,则电极e上发生的反应为:_______________________________,电极f上发生的反应为:__________________,槽中盛放的镀液可以是_______________或_______________(只要求填两种电解质溶液)。
56.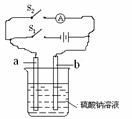 在实验室中可利用右图所示装置模拟氢氧燃料电池的工作原理(a、b两电极为多孔碳棒)。
在实验室中可利用右图所示装置模拟氢氧燃料电池的工作原理(a、b两电极为多孔碳棒)。
(1)合上开关S1,接通电源,电解约半分钟,可在两电极上观察到的现象是 。
则电极a称 极,发生的电极反应为 。
 (2)然后打开S1,合上S2,此时电流表的指针发生偏转,则此装置中a极称为 。
(2)然后打开S1,合上S2,此时电流表的指针发生偏转,则此装置中a极称为 。
55.某研究性学习小组研究外界因素对反应速率的影响。下表是稀硫酸与某金属反应的实验数据:
|
实验序号 |
金属 质量/g |
金属状态 |
C(H2SO4) /mol·L-1 |
V(H2SO4) /mL |
溶液温度/℃ |
金属消失的时间/s |
|
|
反应前 |
反应后 |
||||||
|
1 |
0.10 |
丝 |
0.8 |
50 |
20 |
35 |
200 |
|
2 |
0.10 |
粉末 |
0.8 |
50 |
20 |
36 |
25 |
|
3 |
0.10 |
丝 |
0.8 |
50 |
35 |
50 |
50 |
|
4 |
0.10 |
丝 |
1.1 |
50 |
20 |
34 |
100 |
|
5 |
0.10 |
丝 |
1.1 |
50 |
20 |
44 |
40 |
分析上述数据,回答下列问题:
①实验1和2表明, 对反应速率有影响, 反应速率越快。
②实验1和4的研究的是 对反应速率的影响。
③实验1和3研究的是 对反应速率的影响,实验表明 ,反应速率加快。
④本实验中影响反应速率的其他因素还有 ,其实验序号是 。
⑤实验中的所有反应,反应前后溶液的温度变化值(约15℃)相近,推测其原因: 。
54.通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可以估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
|
化学键 |
Si-O |
Si-Cl |
H-H |
H-Cl |
Si-Si |
Si-C |
|
键能/kJ·mol-1 |
460 |
360 |
436 |
431 |
176 |
347 |
请回答下列问题: (1)比较下列两组物质的熔点高低(填“>”或“<”) SiC______Si;SiCl4_________SiO2 (2)写出工业上用氢气还原四氯化硅制取高纯硅的热化学方程式:
53.钢铁是现代工业不可缺少的材料,是工业的粮食;铁也是人体必需的微量元素,二价铁是血红蛋白输送氧的必需载体,是生命的保护神。请回答下面几道有关铁的问题 (1)家中常用铁锅炒菜,我们常看到刷完的锅若未及时烤干,第二天会在锅中产生了一些铁锈,这是由于发生了原电池反应造成的,请写出 作正极,正极反应式是 , 作负极,负极反应式是 。 (2)制印刷电路时常用三氯化铁溶液作“腐蚀液”,发生反应为:2FeCl3+Cu=2FeCl2+CuCl2。向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,分别在下述情况下,哪些金属阳离子(不考虑阴离子)或金属单质能同时存在。 ①反应后铁有剩余,则容器里还可能有 。 ②反应后容器里含有相当量的Cu2+,则还可能有 。
52.“神舟”五号载人飞船的顺利发送与回收,标志着我国的科技水平达到了一个新的高峰。 (1)为了保持载人飞船座舱内空气成分的相对稳定,科学家提出“金属过氧化物处理系统”,即不断地把座舱内的空气通过盛有金属过氧化物(Na2O2)的容器,并把处理后的气体充入座舱。该方法的有关反应方程式是______________________________________。 (2)若用超氧化钾(KO2)代替Na2O2作为O2的来源,效果更好。等质量的KO2、Na2O2分别与足量的CO2反应生成O2的质量之比为(填最简整数比)__________________。 (3)载人飞船推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水(H2O2)。当它们混合反应时,即产生大量N2和H2O(g),并放出大量的热。已知0.4 mol液态肼与足量的液态双氧水反应,生成N2和H2O(g),放出256.652 kJ的热量。则该反应的热化学方程式为________________________________________________。 (4)如果舱内使用的是甲烷-氧气燃料电池,工作时可将铂电极插入KOH溶液中,然后在两个电极上分别通入CH4和O2。根据两极上反应的实质判断,通入甲烷的一极为电池的______极,若反应生成K2CO3和H2O,则这一极的电极反应式为___________________ _______________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com