
13.在密闭容器中反应:aX(g)+bY(g) cZ(g)+dW(g),反应达到平衡后,保持温度不变,将气体压缩到原来的一半体积,当再次达到平衡时,W的浓度为原平衡的1.8倍。下列叙述不正确的是
( )
cZ(g)+dW(g),反应达到平衡后,保持温度不变,将气体压缩到原来的一半体积,当再次达到平衡时,W的浓度为原平衡的1.8倍。下列叙述不正确的是
( )
A.a+b>c+d B.平衡向逆反应方向移动
C.Z的体积分数减小 D.X的转化率下降
12. 右图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容,据此下列说法正确的是( )
右图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容,据此下列说法正确的是( )
A.该硫酸的物质的量浓度为9.2mol/L
B.1molZn与足量的该硫酸反应产生2g氢气
C.配制200mL、4.6mol/L的稀硫酸需取该硫酸50 mL
D.该硫酸与等质量的水混合所得溶液的物质的量浓度等于9.2mol/L
11.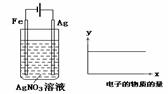 按装置图进行实验,若右图的X轴表示流入阴极的电子的量,则y轴不可能表示的是(假设溶液的体积不变) ( )
按装置图进行实验,若右图的X轴表示流入阴极的电子的量,则y轴不可能表示的是(假设溶液的体积不变) ( )
A.Ag+物质的量浓度
B.NO3-物质的量浓度
C.溶液的pH
D.银棒的质量
10.锂离子电池已经成为新一代实用化的蓄电池,该电池具有能量密度大、电压高的特性。锂离子电池放电时的电极反应式为
负极反应:C6Li-xe-==C6Li1-x+xLi+(C6Li表示锂原子嵌入石墨形成复合材料)
正极反应:Li1-xMO2+xLi++x e-==LiMO2(LiMO2表示含锂的过渡金属氧化物)
下列有关说法正确的是 ( )
A.锂离子电池充电时电池反应为C6Li+Li1-xMO2==LiMO2+C6Li1-x
B.电池反应中,锂、锌、银、铅各失去2mol电子,金属锂所消耗的质量最大
C.锂离子电池放电时电池内部Li+向负极移动
D.锂离子电池充电时阴极反应为C6Li1-x+xLi++x e-==C6Li
9.常温下,0.1mol·L-1某一元酸(HA)溶液中C(H+)=1×10-3,下列叙述正确的是( )
A.该一元酸溶液的pH=1
B.该溶液中HA的电离度为 1% C.该溶液中水的离子积常数为1×10-22 D.若加水稀释,则C(OH-)/C(H+)将减小
8.已知常温时红磷比白磷稳定,在下列反应中:
P4(白磷,s)+5O2(g)====2P2O5(s);△H= -a kJ/mol
4P(红磷,s)+5O2(g)====2P2O5(s);△H= -b kJ/mol
若a、b均大于零,则a和b的关系为 ( )
A.a<b B.a=b C.a>b D.无法确定
7.下列说法正确的是 ( )
A.增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增大
B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大
C.升高温度能使化学反应速率增大主要原因是增加了反应物分子中活化分子的百分数
D.催化剂不影响反应活化能但能增大单位体积内活化分子百分数,从而增大反应速率
6.下列操作会促进H2O的电离,且使溶液pH>7的是 ( )
A.将纯水加热到90℃ B.向水中加少量NaOH溶液
C.向水中加少量Na2CO3溶液 D.向水中加少量FeCl3溶液
5.下列有关化学实验操作的叙述正确的是 ( )
A.用待测液润洗滴定用的锥形瓶
B.配制FeCl3溶液时,向溶液中加入少量Fe和稀盐酸
C.用稀盐酸洗涤盛放过石灰水的试剂瓶
D.Na2 CO3溶液保存在带玻璃塞的试剂瓶中
CO3溶液保存在带玻璃塞的试剂瓶中
4.关于原电池和电解池的叙述正确的是 ( )
A.原电池失去电子的电极称为阴极
B.电解池的阳极、原电池的负极都发生氧化反应
C.原电池的两极,一定要由活动性不同的两种金属组成
D.电解时电解池的阳极一定是阴离子放电
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com