
19.(10温州)小明向氢氧化钠溶液中滴加了稀盐酸,发现没有明显现象。为了判断两者是否恰好完全反应,他取少量反应后的溶液加入试管中,滴加几滴无色酚酞试液,振荡后观察到酚酞试液不变色。
(1)根据上述现象,小明得出“两种物质恰好完全反应”的结论。小白认为小明的结论是不合理的,其理由是 ▲ 。
(2)小白利用pH试纸测反应后溶液的pH,以确定两者是否恰好完全反应。请你选用其它
试剂再设计一个实验,以验证氢氧化钠和盐酸是否恰好完全反应(要求写出选用的试
剂、可能观察到的现象和相应的结论) ▲ 。
(3)小白为了继续探究“在氢氧化钠与盐酸反应的过程中,溶液的pH是如何变化的”这一
问题,进行如下实验:在一定量的氢氧化钠溶液中逐渐滴加盐酸,用pH试纸测定溶液
的pH,记录数据如下表:

下图中能合理表示该反应过程中pH变化的图像是 ▲ 。

18.(1)②→①→③(或②①③)
(2)21:44
(3)AC(漏选得1分,不选、错选均不得分)
18.(10义乌) 2010年5月12日,在苍茫海水中沉没了800多年的“南海一号”重见天日,其中的宋代铜钱已经锈迹斑斑。已知:铜绿的主要成分是碱式碳酸铜[Cu2(OH)2CO3],它受热分解的化学方程式为:
2010年5月12日,在苍茫海水中沉没了800多年的“南海一号”重见天日,其中的宋代铜钱已经锈迹斑斑。已知:铜绿的主要成分是碱式碳酸铜[Cu2(OH)2CO3],它受热分解的化学方程式为:
 某同学设计了如下实验,用来测定碱式碳酸铜受热分解后产生的水和二氧化碳的质量比。
某同学设计了如下实验,用来测定碱式碳酸铜受热分解后产生的水和二氧化碳的质量比。
实验用到的主要装置为:
装置连接顺序为: __ 。(填写编号)
(2)操作步骤及数据处理:
第一步 检查气密性;
 质 装置 质 装置量 时间 |
装置① |
装置③ |
|
实验前 |
220.0克 |
195.0克 |
|
实验后 |
222.1克 |
199.4克 |
第二步 装入药品,称取装置①和③的质量;
第三步 试验后再次称取装置①和③的质量,记录数据如表;
根据以上数据可得产生的水和二氧化碳的质量之比为 __ __ 。(要求写出最简整数比)
(3)结果分析;从下列选项中选出产生该实验结果可能的原因有哪些? __ __
A.二氧化碳没有被完全吸收 B.水没有被完全吸收
C.碱式碳酸铜药品中含有水分 D.碱式碳酸铜没有完全分解
17.(1)浓硫酸 (2)对调装置E、F的位置
水蒸气的吸收应在通溶液之前(或“著按原装置,前者会把水蒸气带给后者”)
(3)防止空气中的CO,进入吸收装置(或“保护装置”)。
17.(10金华)由于大量使用一次性塑料方便袋造成的“白色污染”,已成为一个严重的社会问题。某科学研究小组的同学欲对某种塑料的组成进行分析探究(资料显示该塑料只吉C、H两种元素),他们设计了如图所示的实验装置。目的是通过测量有关数据,推算塑料组成元素的含量。
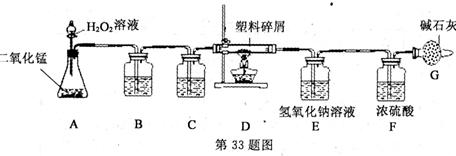
图中字母A至G均表示装置编号。靖根据实验装置,回答下列问题:
(1)由于发生装置A制取的氧气中混有co。和水蒸气,为使D装置中塑料试样在纯氧中燃烧,装置C中盛放的试剂应该是 ;
(2)E、F装置是气体的吸收装置,该处的设计有不正确的地方,如何改进 .理由是 ;
(3)碱石灰的成分是氢氧化钠和氧化钙,则装置连接正确时G装置的作用是 。
16.:31. (1)C, (2) Ba(NO3)2 HNO3或HCl ;CO2 + Ba(OH)2 == BaCO3↓+H2 O;
(3)NTaCl(或氯化钠)
16.(10杭州)某学校的课外活动小组要测定某块盐碱地中的NaCl、Na2SO4;、Na2CO3的含量,为盐碱地的改造提供依据。下面是他们的测定步骤:
(1)确定要测定地块的采样点。
(2)将采集好的土样晾干、粉碎、称量,加蒸馏水充分搅拌后过滤,取滤液。
(3)对所取滤液进行以下实验:(实验过程中所加试剂均是足量的,得到的所有沉淀中的阴离子都来自原土壤滤出液中)
(4)称量实验中得到的各种沉淀质量,计算得出盐碱地中上述三种盐的含量。

请回答下列问题:
(1)设计采样点时有下列四种方案,选用方案__ __较为合理。

A B C D
(2)上述实验中试剂A的化学式是 ,试剂B的化学式是 ,气体和试剂C反应的化学方程式是__ 。
(3)若上述实验中试剂A为氯化钡溶液,则按上述实验步骤最终测得土壤中 的含量偏高。
15. (l)Ca(OH)z(或氢氧化钙) (2) Ba(N03)2 +Na2S04 =BaS04↓ +2 NaN03 (3) AgCl
15.(10台州)豆腐加工时需加入凝固剂,凝固剂的化学成分是什么?通过资料获悉:凝圊剂中可能含有Naz SO;、Ca(OH)2、MgClz、NaCl等,为验证其成分,小柯进行了如下实验:

(1)根据以上现象,凝固剂溶液中肯定没有 。
(2)写出实验2中发生的化学反应方程式: 。
(3)写出实验3中出现的白色沉淀物质的化学式 。
14.(1)BaCl2
(2)CuSO4+2NaOH Cu(OH)2↓+Na2SO4
(沉淀符号漏写不扣分,化学式错误、配平错误均不得分,“=”写成“-”视为配平错误)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com