
3. China began selling tickets for the Wuhan-Guangzhou high-speed railway, ______ boasts the world's fastest train journey with a 350km per hour average speed.
A. which B. that C. it D. what
2. The officials said the downward trend of A/H1N1 flu activity did not______ mean the worst was over. Flu activity might pick up next year.
A. greatly B. necessarily C. fully D. nearly
第一节 单项填空(共20小题;每小题1分,满分20分)
1. Many people believe we are heading for environmental disaster _____ we basically change the way we live.
A. but B. although C. unless D. once
8.(1)化学………………………………………………………………………………(1分)
(2)解:设需消耗纯稀硫酸x克,同时生成水y克。
PbO2 (固)+ 2H2SO4 + Pb = 2PbSO4 ↓+ 2H2O
196 207 36
x 310.5克 y
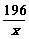 =
=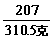 x =294克 …………………………………(2分)
x =294克 …………………………………(2分)
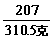 =
= 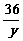 y=54克
…………………………………(1分)
y=54克
…………………………………(1分)
原来m溶质=1200克×36%=432克 剩余m溶质=432克-294克=138克 …………(1分)
剩余m溶液=1200克-294克+54克=960克 ………………………………………(1分)
剩余H2SO4 %=138克/960克=14.38% ……………………………………………(1分)
答:需消耗稀硫酸中溶质为294克,此时电瓶中硫酸溶液中溶质的质量分数是14.38%。
(其他合理解法也给分)
8.(10嘉兴)电动自行车、小汽车等交通工具中都有为其提供电能的铅蓄电池(又称“电瓶”),它的优点
是可以充电循环使用。电瓶的正极材料是二氧化铅(PbO2),负极材料是金属铅(Pb),电瓶内所加液体是溶质质量分数为36%的稀硫酸,放电(为外界供电)时发生反应的化学方程式如下:
PbO2 (固)+ 2H2SO4 + Pb = 2PbSO4 ↓+ 2H2O
当放电时,反应物反应掉一定量后,就会导致电压下降,不能正常使用,这时就必须及时充电。
(1)电瓶在放电时, ▲ 能转化为电能。
(2)假如某个电瓶中铅的质量为1800克,内装36%的稀硫酸1200克,当有310.5克的铅参加反应时,需消耗稀硫酸中溶质多少克?此时电瓶中硫酸溶液溶质的质量分数是多少?
(最后结果保留两位小数)
7.(它解法正确同样给分)
(1)解:设参加反应的CuO的质量为X
H2+CuO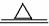 Cu十H2O 减少的固体质量
Cu十H2O 减少的固体质量
80 64 16
X 8克
80:16=X:8克
X= 40克
答:参加反应的CuO的质量为40克
(2)23%
7.(10杭州) 在氢气还原氧化铜的实验中,向50克氧化铜粉末中通氢气,加热一段时间后,测得固体质量减少8g,求:
在氢气还原氧化铜的实验中,向50克氧化铜粉末中通氢气,加热一段时间后,测得固体质量减少8g,求:
(1)已反应掉的氧化铜质量。(列式计算)
(2)若实验时用的氢气,是用右图标签所示的浓硫酸稀释成稀硫酸后和足量的锌粒反应制取的。取用浓 硫酸50毫升,小心加入到300毫升水中稀释,稀释后硫酸溶液的溶质质量分数为 。
6.(1)B
(2)a 用水吸收(或用碱溶液吸收,如氢氧化钠或石灰水等)
(3)解法一:设需要20%硫酸溶液的质量为X克
H2 S04 +FeS =H2S↑++FeS04
98 34
20%X 6.8克
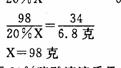
答,需要20%硫酸溶液质量为98克
解法二:设需要硫酸为X克
H2 S04 +FeS=H2S↑十+FeS04
98 34
X 6.8克
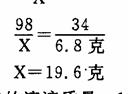
稀硫酸的溶液质量=19.6克/20%=98克
答:需要20%硫酸溶液质量为98克
6.(10台州)硫化氢(H2S)是一种具有臭鸡蛋气味的致命毒气,它的密度比空气大,可溶于水形成氢硫酸,氢硫酸具有酸的通性。实验室常用固体硫化亚铁(FeS)和稀硫酸在常温下制得H2S,同时生成FeS04。
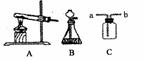
(1)在右图中,应选用图 作为制取H2S的装置。
(2)收集H2S气体时,应从C装置中的 导管进入,对产生尾气的处理方法
是: 。
(3)实验室若制取6.8克的硫化氢气体,理论上需要多少克20%的硫酸溶液?
5.(1)C
(2)4.4
设参加反应的HC1的质量为X克
CaC03+2HCI=CaCIz+COz↑ +Hz0
73 44
X 4. 4g
73:44=X:4.4g
X=7. 3g
HCl%=7.3g/lOOg=7.3%
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com