
71、(江苏省江浦高级中学2010届高三模块复习,21)
 A、B、C、D、E、F是元素周期表前四周期的元素,它们在元素周期中的位置如下图所示:
A、B、C、D、E、F是元素周期表前四周期的元素,它们在元素周期中的位置如下图所示:
⑴写出F的基态原子核外电子排布式:__________________。
⑵C元素的第一电离能比同周期相邻的两种元素的第一电离能都高的原因是__________。
⑶由A、B、D三种元素形成的一种物质俗称光气,分子中A原子采取sp2杂化成键。光气分子的结构式是___________,其中碳氧原子之间共价键是_____(填序号):
 a.2个σ键 b.2个π键 c.1个σ键、1个π键
a.2个σ键 b.2个π键 c.1个σ键、1个π键
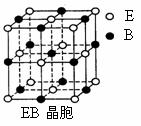
⑷EB晶胞如右下图所示,EB晶体中E2+的配位数为_____,EB晶体和NaCl晶体中离子排列方式相同,其晶格能分别为:EB为3401kJ/mol、NaCl为786kJ/mol。导致两者晶格能差异的2点原因是____________。
⑴ 1s22s22p63s23p63d24s2(2分)
⑵ sp3(2分)
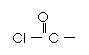 ⑶
(2分) c(2分)
⑶
(2分) c(2分)
⑷ 6 (2分) CaO晶体中离子的电荷数大于NaCl,离子间的平均距离小于NaCl(2分)
高频考点二十五 有机化学基础
70、(福建省龙岩一中2009-2010学年度高三第七次月考,30)现有部分前四周期元素的性质或原子结构如下表:
|
元素编号 |
元素性质或原子结构 |
|
A |
第三周期中的半导体材科 |
|
B |
L层s电子数比p电子数少l |
|
C |
地壳中含量最高的元素 |
|
D |
第三周期主族元素中其第一电离能最大 |
|
E |
第四周期中未成对电子数最多 |
( 1)写出元素E基态原子的电子排布式: 。
(2)B单质分子中,含有
个 键和
个
键和
个 键,元素B的气态氢化的空间构型为
。
键,元素B的气态氢化的空间构型为
。
(3)A、B、C第一电离由大到小的顺序为(用元素符号表示): ;
(4)C单质的熔点 A单质的熔点(填“高于”或“低于”),其原因是:
。
(1)ls22s22p63s23p63d54s1(2)1 2 ,三角锥形
(3)N>O>Si
(4)低于 C12晶体属于分子晶体,Si晶体属于原子晶体,原子晶体中原子之间以很强的共价键结合,而分子晶体中分子间以较弱的分子间作用力结合,因而原子晶体的熔点比分子晶体的熔点高。
69、(银川一中2010届高三年级第六次月考,34)A、B、C、D为前四周期元素。A元素的原子价电子排布为ns2np2,B元素的最外层电子数是其电子层数的3倍,C元素原子的M电子层的P亚层中有3个未成对电子,D元素原子核外的M层中只有2对成对电子。
(1)当n=2时,AB2属于_______分子(填“极性”或“非极性”),分子中有_____个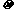 键,_____个
键,_____个 键。(6分)
键。(6分)
(2)当n=3时,A与B形成的晶体属于__________晶体。(2分)
(3)若A元素的原子价电子排布为3s23p2,A、C、D三种元素的第一电离能由大到小的顺序是________________(用元素符号表示)(2分)
 (4)已知某红紫色络合物的组成为CoCl3•5NH3•H2O。该络合物中的中心离子钴离子在基态时核外电子排布式为___________________,作为配位体之一的NH3分子的空间构型为_________________________。(4分)
(4)已知某红紫色络合物的组成为CoCl3•5NH3•H2O。该络合物中的中心离子钴离子在基态时核外电子排布式为___________________,作为配位体之一的NH3分子的空间构型为_________________________。(4分)
(5)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如右图所示。体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为_______。(3分)
(1)非极性(2分),2(2分),2(2分) (2)原子(2分)
(3)P>S>Si(2分)
(4)Co3+[Ar]3d6(2分),三角锥形(或四面体)(2分)
(5)1:2(3分)
0.(1)-92.4kJ/mol (2)057(mol·L-1)2,①②
(3)②;通过温度的改变而改变物质的状态,达到分离的目的。(如果没有谈到状态的改变,而只说温度不得分)。
(4)8NH3+3Cl2=N2+6NH4Cl (5)25mL;小于
高频考点二十四 物质结构与性质
68、(哈尔滨三中、东北育才、大连育明、天津耀华2010年四校第一次联考,36)工业上合成氨是在一定条件下进行如下反应:N2(g)+3H2(g) 2NH3(g),其
部分工业流程如下:
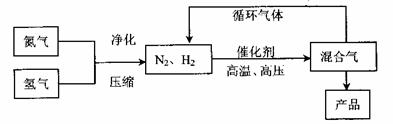
回答下列问题:
(1)已知:N2(g)+O2(g)=2NO(g) △H=180.5kJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H=-905kJ/mol
2H2(g)+O2(g)=2H2(g) △H=-483.6kJ/mol
 则N2(g)+2H2 2NH3(g)的△H=
;
则N2(g)+2H2 2NH3(g)的△H=
;
(2)如果工业上,在一定温度下,将1.5molN2气体和6molH2气体通入到体积为1升的密闭容器中。当反应达到平衡时,容器内气体的压强为起始时的80%,则其平衡常数为 。改变下列条件,能使平衡向正反应方向进行且平衡常数不变的是 ;
①增大压强 ②增大反应物质的浓度
③使用催化剂 ④降低温度
(3)合成氨反应的平衡常数很小,所以在工业采取气体循环的流程。即反应后通过降低混合气体的温度而使氢气分离出来。这种分离物质的方法其原理类似于下列哪种方
法? (填编号)
①过滤 ②蒸馏 ③渗析 ④萃取
理由是 ;
(4)可以用氯气来检验输送氨气的管道是否漏气,如果漏气则会有白烟(成份为氯化铵)生成。该反应的化学方程式为 ;
(5)假如该厂生产氨水的物质的量浓度为20mol/L,实验室若需用80mL浓度为5mol/L的氨水时,需取20mol/L的氨水 mL(用100mL的容量瓶)。假如该氨水的pH=a,加入相同体积的盐酸时,溶液呈中性,则此盐酸的pH 14-a(填“大于”“小于”或“等于”)。
67、(哈师大附中、东北师大附中、辽宁省实验中学2010年高三第一次联合模拟,36)磷化铝、磷化锌、磷化钙是我国目前最常见的熏蒸杀虫剂,都能与水或酸反应产生有毒气体膦(PH3),PH3具 有较强的还原性,能在空气中自然。我国粮食卫生标准(GB2175-2005)规定,粮食中磷化物(以PH3计)含量≤0.05mg/kg。
有较强的还原性,能在空气中自然。我国粮食卫生标准(GB2175-2005)规定,粮食中磷化物(以PH3计)含量≤0.05mg/kg。
通过下列方法对粮食中残留磷化物含量进行测定。
[实验课题]粮食中残留磷化物的定量测定
[实验原理]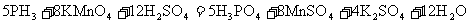
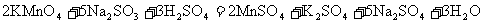
[操作流程]安装蒸馏吸收装置→PH3的产生与吸收→转移褪色→亚硫酸标准溶液滴定
[实验装置]
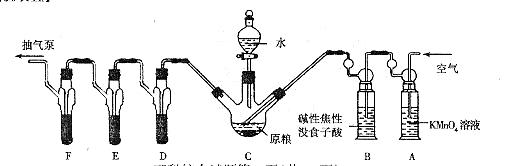
C中盛有200g原粮;D、E、F各盛装1.00mL浓度为1.00×10-3mol/L的KMnO4的溶液(H2SO4酸化)
(1)以磷化铝为例,写出磷化物与水反应的化学方程式________________________。
(2)检查上述装置气密性的方法是________________________。
(3)实验过程中,用抽气泵抽气的目的是________________________。
(4)A中盛装KmnO4溶液是为除去空 气中可能含有的________________________;B中盛装碱性焦性没食子酸溶液的作用是________________________;如去除B装置,则实验中测得的PH3含量将________________________。
气中可能含有的________________________;B中盛装碱性焦性没食子酸溶液的作用是________________________;如去除B装置,则实验中测得的PH3含量将________________________。
(5)收集D、E、F所得吸收液,并洗涤D、E、F,将吸收液、洗涤液一并置于锥形瓶中,加水稀释至25mL,用浓度为5×10-4mol/L Na2SO3标准溶液滴定剩余的KMnO4溶液,消耗Na2SO3标准溶液11.00mL,则该原粮中磷化物(以PH3计)的含量为_______________mg/kg。

66、(东北师大附中2010届三模,26)某人设想以下图所示(含有某种催化剂的)装置用电化学原理生产硫酸
(1)写出通入SO2的电极的电极反应式
 (2)若通入SO2的速率为2.24
L••min-1(标准状况),为稳定持续生产,硫酸溶液的浓度应维持不变,求左侧水的流入速率(结果用mL••min-1表示)
(2)若通入SO2的速率为2.24
L••min-1(标准状况),为稳定持续生产,硫酸溶液的浓度应维持不变,求左侧水的流入速率(结果用mL••min-1表示)
(1)SO2+2H2O-2e-= SO42-+4 H+(2分)
(2)13.4 mL••min-1(3分)
高频考点二十三 化学与技术
65、(江苏省江浦高级中学2010届高三模块复习,20)我省物产资源丰富。东海有蛭石,蛭石为一种层状结构的含镁的铝硅酸盐,是黑云母等天然矿物风化蚀变的产物,因为其受热膨胀时呈挠曲状,形态酷似水蛭,故此得名蛭石。膨化后的蛭石呈颗粒状,有隔热、耐冻、抗菌、防火、吸声等优异性能,但不耐酸。
⑴某硅酸盐矿石的组成可以看作SiO2中有1/4的Si被Al置换,再由Mg平衡其电荷形成的。该矿石的组成以氧化物形式表示为 ________________________ 。
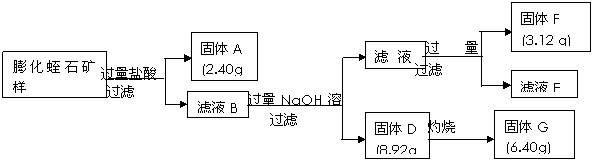 ⑵某校研究性学习小组取得了某种牌号的膨化蛭石样品,其成分可以用氧化物(MgO、Fe2O3、Al2O3、SiO2、H2O)的形式表示。为研究蛭石的组成,拟进行实验探究,实验流程及相关数据如下:
⑵某校研究性学习小组取得了某种牌号的膨化蛭石样品,其成分可以用氧化物(MgO、Fe2O3、Al2O3、SiO2、H2O)的形式表示。为研究蛭石的组成,拟进行实验探究,实验流程及相关数据如下:
①固体A的化学式是 _____________ ;②固体F的物质的量是 ___________________ ;
③通过计算,给出用氧化物的形式表示某种膨化蛭石组成的化学式。
(1)MgO·Al2O3·6SiO2 (2分)
(2)①SiO2 (2分) ②0.040mol (2分)
③n(SiO2)= = 0.04mol(1分)
设 固体G中Fe2O3的物质的量为x mol,MgO的物质的量为y mol
依题意有:
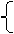 160x+40 y=6.40
160x+40 y=6.40
214x+58 y=8.92
解得:x=0.020 mol y=0.080 mol (2分)
由②知: n(Al2O3)=0.020mol
于是n(H2O)= (11.20-40×0.08-60×0.04-160×0.020-102×0.020)÷18=0.02 (mol)
则: n(MgO ) :n(Fe2O3) :n(Al2O3) : n(SiO2) : n(H2O)
=0.080mol :0.020mol :0.020mol :0.04mol:0.02mol
==8 :2 :2 :4:2
==4 :1 :1 :2:1
即该蛭石矿的组成为: 4MgO·Al2O3·Fe2O3·2SiO2·H2O (3分))
(不化简扣1分)
64、(哈师大附中、东北师大附中、辽宁省实验中学2010年高三一模,28)pC类似pH,是指极稀溶液中溶质物质的量浓度的常用对数负值。如某溶液溶质的浓度为1×10-3mol/L,则溶液中该溶质的pC = -lg10-3 = 3。已知H2CO3溶液中存在下列平衡:
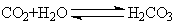
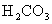
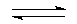
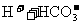
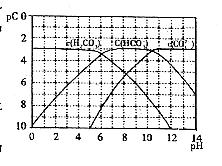
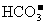

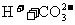
右图为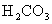 、
、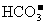 、
、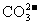 在加入强酸或强碱溶液后,平衡时溶液中三种成分的pC-pH图。请回答下列问题:
在加入强酸或强碱溶液后,平衡时溶液中三种成分的pC-pH图。请回答下列问题:
(1)在pH = 9时,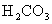 溶液中浓度最大的含碳元素离子为_______________。
溶液中浓度最大的含碳元素离子为_______________。
(2)pH<4时,溶液中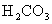 的pC值总是约等于3的原因是_______________。
的pC值总是约等于3的原因是_______________。
(3)一定浓度的NaHCO3和NaCO3混合溶液是一种“缓冲溶液”,在这种溶液中加入少量的强酸或强碱,溶液的pH变化都不大,请用离子方程式表示加入少量强碱后其pH变化不大的原因______________________________。
(4)已知M2CO3为难溶物,则其KSP的表达式为_______________;现欲将某溶液中的M+以碳酸盐(KSP = 1×10-12)的形式沉淀完全,则最后溶液中的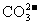 的pC最大值为_______________(溶液中的离子浓度小于1×10-5mol/L时,沉定完全)。
的pC最大值为_______________(溶液中的离子浓度小于1×10-5mol/L时,沉定完全)。
(5)若某溶液中含3mol Na2CO3,滴入一定量的稀盐酸,恰好使溶液中Cl-和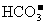 的物质的量之比为2:1,则滴入的盐酸中HCl的物质的量等于_______________mol。
的物质的量之比为2:1,则滴入的盐酸中HCl的物质的量等于_______________mol。

63、(山东省实验中学2010届高三第二次诊断性测试,24)某课外兴趣小组测定某品牌牛奶中钙的含量,方法如下:取100mL牛奶,加入足量的草酸铵[(NH4)2C2O4]溶液,使牛奶中的钙转化成难溶的CaC2O4沉淀;过滤,用适量的蒸馏水洗涤沉淀表面吸附的少量(NH4)2C2O4、蛋白质等杂质;将沉淀转移至锥形瓶中,加足量的稀硫酸溶液溶解CaC2O4;然后以0.10mol·L-1的KMnO4溶液滴定生成的H2C2O4溶液,共消耗12.00mLKMnO4溶液。发生的反应为:
5H2C2O4+2KMnO4+3H2SO4 = 5CO2↑+2MnSO4+K2SO4+8H2O
(1)KMnO4溶液应盛在_________(填“酸式”或“碱式”)滴定管中。
(2)若滴定管的规格为25mL,滴定前滴定管中液面的读数为5.20 mL,则滴定管中液体的体积为______(填代号)。
A.5.20 mL B.19.80 mL C.大于19.80 mL D.小于19.80 mL
(3)本实验是否需要外加指示剂? (填“是”或者“否”)。到达滴定终点时,溶液的颜色由 色变为 色。
(4)滴定时边滴边摇动锥形瓶,眼睛应观察
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
(5)该牛奶中钙的含量为_________mg/100mL。
(6)下列操作会使实验结果偏低的是____________(填代号)。
A.滴定管未用KMnO4溶液润洗就直接盛装KMnO4溶液
B.向锥形瓶转移沉淀时,损失部分沉淀
C.开始时平视读数,滴定完成时俯视读数
D.CaC2O4的表面没有洗涤干净,吸附少量C2O42-等杂质
(1)酸式(1分) (2)C(2分) (3)否 (1分),紫红(1分),无色(1分)
(4) B (1分) (5)120(2分) (6)BC(2分)
高频考点二十二 化学计算
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com