
6.见贤思齐焉,见不贤而内自省也。--《论语》
5.君子欲讷于言而敏于行。--《论语》
4.躬自厚而薄责于人,则远怨矣。--《论语》
3.见善如不及,见不善如探汤。--《论语》
2.当仁,不让于师。--《论语》
1.君子成人之美,不成人之恶。小人反是。--《论语》
10、选修三(以下所列提纲为需要掌握的常考的内容)
(1)原子结构与性质
P4~5电子层(能层)与原子轨道(能级),以及容纳的电子数
多电子原子的核外电子的能量 (填“相同”或“不同”)。同一能层的电子,能量也可能不同,可以把它们分为 。能层由内到外的符号分别为 、 、M、 、 、P、Q。能级有 、 、 、 等,每个能级分别对应 个、 个、 个、 个原子轨道,每个能级又对应 个、 个、 个、 个电子。
P6~7 1~36号元素的电子排布式和价电子排布式。常考第四周期的21号钪~36号氪
写出构造原理的排列顺序: 4f、5d、6p……
写出下列元素的电子排布式:
Ti Cr Mn Fe
Ni Cu Ge Se
P8 光谱分析
P10~11 电子云,电子与轮廓图,原子轨道(注意90%的概率)。S、P电子的原子轨道的形状(球形,纺锤形)。
P12 核外电子分层排步遵循的原理:能量最低原理,泡利原理,洪特规则。
P15元素周期表分区简图
P16~18 原子半径的变化规律。了解同周期,同主族中元素第一电离能的变化规律,了解电离能和原子核外电子排布的关系
P18~19了解同周期,同主族中元素电负性的变化规律,能根据电负性元素金属性和非金属性的变化规律
|
|
第一电离能 |
电负性 |
|
同一周期 |
(写出特例) |
|
|
同一主族 |
|
|
[研究题87](08海南卷)在基态多电子原子中,关于核外电子能量的叙述错误的是 ( )
A.最易失去的电子能量最高 B.电离能最小的电子能量最高
C.p轨道电子能量一定高于s轨道电子能量
D.在离核最近区域内运动的电子能量最低
(2)化学键与物质的性质
P78 理解离子键的含义,能说明离子键的形成。
P78~80了解NaCI型和CsCI型离子晶体的结构特征,能用晶格能解释典型离子化合物的物理性质。 P28~32了解共价键的主要类型σ键和丌键,能用键能、键长、键角等数据说明简单分子的某些性质(对d键和兀键之间相对强弱的比较不作要求) ,共价键的具有方向性和饱和性(但是s-sσ键没有方向性)
|
σ键特征 |
σ键的种类 |
||
|
|
|
|
|
|
对应的代表物 |
|
|
|
P45~46了解极性键和非极性键,了解极性分子和非极性分子及其性质的差异。
P34 等电子原理和等电子体能结合实例说明“等电子原理”的应用
P37~40 价层电子对互斥模型(VSEPR模型)、杂化轨道理论与分子构型联系记忆。
AB4型,sp3杂化,VSEPR模型为四面体,如CH4(正四面体),NH3(三角锥),H2O(V型);
AB3型,sp2杂化,VSEPR模型为平面三角形,如甲醛,乙烯,苯;
AB2型,sp杂化,VSEPR模型为直线型,如CO2,HCN,乙炔,
[研究题88](08海南卷).在硼酸[B(OH)3]分子中,B原子与3个羟基相连,其晶体具有与石墨相似的层状结构。则分子中B原子杂化轨道的类型及同层分子间的主要作用力分别是( )
A.sp,范德华力 B.sp2,范德华力 C.sp2,氢键 D.sp3,氢键
P68~69了解原子晶体的特征,能描述金刚石、二氧化硅等原子晶体的结构与性质的关系。
[研究题89](1)含1molC原子的金刚石中,C-C键的数目是 ;
含1molC原子的石墨中,C-C键的数目是 ,六元环的个数是
(2)含1molSi原子的晶体硅中,Si-Si键的数目是 ;
含1molSi原子的二氧化硅中,Si-O键的数目是 ;
P73 能用金属键的自由电子理论解释金属的一些物理性质
[研究题90](08四川卷)下列说法中正确的是( )
A.离子晶体中每个离子的周围均吸引着6个带相反电荷的离子
B.金属导电的原因是在外加电场的作用下金属产生自由电子,电子定向运动
C.分子晶体的熔沸点低,常温下均呈液态或气态
D.原子晶体中的各相邻原子都以共价键相结合
P73~76金属晶体中的原子堆积方式:①简单立方堆积如钋;②钾型(体心立方)如碱金属、铁;③镁型如镁、锌、钛;④铜型(面心立方)如铜、银、金。注意看P79资料卡片总结的四种堆积方式的晶胞图、配位数、以及空间利用率的相对大小。
P41~42了解简单配合物的成键情况(配合物的空间构型和中心原子的杂化类型不作要求)。
|
配合物 |
中心原子(离子) |
配位体 |
配位数 |
配位离子的书写 |
|
[Cu(NH3)4](OH)2 |
|
|
|
|
|
[Ag(NH3)2]OH |
|
|
|
|
|
K4[Fe(CN)6] |
|
|
|
|
|
Na3[AlF6] |
|
|
|
|
|
[Co(NH3)5Cl]Cl2 |
|
|
|
|
[研究题91](2006 广东10)下列物质性质的变化规律,与共价键的键能大小有关的是 ( )
A.F2、Cl2、Br2、I2的熔点、沸点逐渐升高
B.HF、HCl、HBr、HI的热稳定性依次减弱
C.金刚石的硬度、熔点、沸点都高于晶体硅
D.NaF、NaCl、NaBr、NaI的熔点依次降低
(3)分子间作用力与物质的性质
P65 晶胞的定义;“无隙并置”;会用均摊法计算各种晶胞中原子的个数。注意贡献率的不同:长方体顶点1/8,面上1/2,棱上1/4,体内1;六棱柱顶点1/12;等等。
P47知道分子间作用力的含义,了解化学键和分子间作用力的区别
P65~66知道分子晶体的含义,了解分子间作用力的大小对物质某些物理性质的影响。 P48了解氢键的存在对物质性质的影响(对氢键相对强弱的比较不作要求) 哪些物质含有氢键:
分子间氢键和分子内氢键的差别和例子
P65~79了解分子晶体与原子晶体、离子晶体、金属晶体的结构微粒、微粒间作用力的区别。 [研究题92](2007山东 32)请完成下列各题:
⑴前四周期元素中,基态原子中未成对电子数与其所在周期数相同的元素
有 种。
⑵第ⅢA、ⅤA族元素组成的化合物GaN、GaP、GaAs等是人工合成的新型半导体材料,其晶体结构与单晶硅相似。Ga原子的电子排布式为 。在GaN晶体中,每个Ga原子与 个N原子相连,与同一个Ga原子相连的N原子构成的空间构型为 。在四大晶体类型中,GaN属于 晶体。
 ⑶在极性分子NCl3中,N原子的化合价为-3价,Cl原子的化合价为+1价,请推测NCl3水解的主要产物是
(填化学式)。
⑶在极性分子NCl3中,N原子的化合价为-3价,Cl原子的化合价为+1价,请推测NCl3水解的主要产物是
(填化学式)。
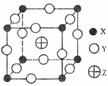
[研究题93](08海南卷)已知X、Y、Z三种元素组成的化合物是离子晶体,其晶胞如图所示,则下面表示该化合物的化学式正确的( )
A.ZXY3 B.ZX2Y6C.ZX4Y8 D.ZX8Y12
[研究题94](08山东卷)氮是地球上极为丰富的元素。
(1)Li3N晶体中氮以N3-存在,基态N3-的电子排布式为 。
(2)N≡N的键能为942 kJ·mol-1,N-N单键的键能为247 kJ·mol-3,计算说明N2中的
键比
键稳定(填“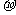 ”“
”“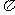 ”)。
”)。
 (3)(CH3)3NH+和AlCl-4可形成离子液体。离子液体由阴、阳离子组成,熔点低于100℃,其挥发性一般比有机溶剂
(填“大”或“小”),可用作 (填代号)。
(3)(CH3)3NH+和AlCl-4可形成离子液体。离子液体由阴、阳离子组成,熔点低于100℃,其挥发性一般比有机溶剂
(填“大”或“小”),可用作 (填代号)。
a、助燃剂 b、“绿色”溶剂
c、复合材料 d、绝热材料
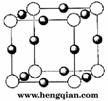
(4)X*中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体结构如图所示。X的元素符号是 ,与同一个N3-相连的X*有 个。
(6月5日)
[研究题87]C [研究题88]C
[研究题89](1)2NA ; 1.5NA;0.5NA; (2)2NA ; 4NA;
[研究题90]D [研究题91]BC
[研究题92](1)5 (2)1s22s22p63s23p63d104s24p1(或[Ar]3d104s24p1) 4 正四面体 原子 (3)HClO NH3·H2O
[研究题93]A
[研究题94] (1)1s22s22p6 (2)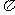
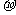 (3)小 b (4)Cu
6
(3)小 b (4)Cu
6
74、(天津一中2010届高三上学期第三次月考 ,23)
,23)
I. 有机化合物A 一E的转化如下列反应框图所示,1molA和2molH2在一定条件下恰好反应,生成饱和一元醇X,X中碳元素的质量分数为65%。
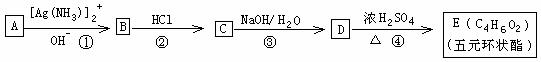
(1)X的分子式为____________________
(2)A分子中所含官能团的名称是_____________________________
(3)上述转化①一④步反应中,属于取代反应类型的是__________________
(4)C的结构简式为_________________________
(5)D→E的反应方程式为_________________________________
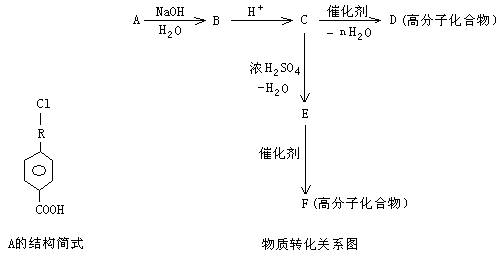 II 有机物A的相对分子质量为198.5,其结构简式如下(-R-代表某种烷基),已知在光照条件下,A分子中的一个氢原子被氯原子取代时只得到一种产物,A在一定条件下还有下图所示的反应关系:
II 有机物A的相对分子质量为198.5,其结构简式如下(-R-代表某种烷基),已知在光照条件下,A分子中的一个氢原子被氯原子取代时只得到一种产物,A在一定条件下还有下图所示的反应关系:
(1)A的分子式为______________
(2)A→B的化学方程式为________________________________________________
(3)写出E中所含官能团的名称____________________;C→D的反应类型_________________
(1) C4H10O 1分
(2)醛基 碳碳双键 各1分
(3) 3、4 2分
(4)CH2Cl CH2 CH2CH2COOH 2分
(5)HOCH2 CH2
CH2CH2COOH 
 + H2O 2分
+ H2O 2分
(1)C10H11O2Cl 2分
(2)
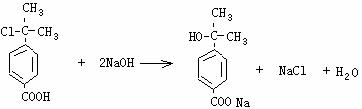
2分
(3)碳碳双键 羧基 各1分
聚合反应(缩聚反应) 1分
73、(哈尔滨三中、东北育才、大连育明、天津耀华2010年四校第一次联考,38)柠檬酸三丁酯(TBC)是绿色环保的增塑剂,应用极其广泛,它的结构式如左下图,
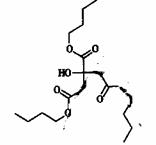
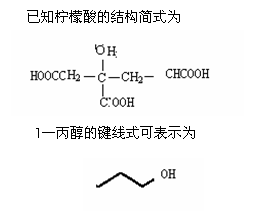
试回答:
(1)TBC的分子式为 ,在研究TBC的结构时要用到一种谱图(如下),用于推测 等信息,它是 图(填序号);
A.核磁共振氢谱 B.红外光谱 C.质谱

(2)1-丁醇在一定条件下可生成1-丁醇,反应类型为 ,化学方程式为 ,TBC在该条件下 (填“能”或“不能”)生成含醛基的化合物;
(3)柠檬酸与甲醇反应生成柠檬酸三甲酯的化学方程式 ;
(4)合成TBC时,不同条件对酯化学率的影响如下表:
|
n(酸):n(醇) |
1:5.0 |
1:5.5 |
1:6.0 |
1:6.5 |
1:7.0 |
|
酯化率/% |
95.1 |
96.3 |
97.0 |
97.4 |
97.2 |
|
时间/h |
0.5 |
1.0 |
2.0 |
3.0 |
5.0 |
|
酯化率/% |
40.0 |
70.2 |
94.3 |
97.4 |
97.4 |
|
温度/°C |
130 |
140 |
145 |
150 |
160 |
|
酯化率/% |
89.5 |
96.2 |
97.4 |
97.4 |
97.2 |
酯化反应时应选择的条件如下:它们分别是n(酸):(醇)、时间、温度,其中最佳的是: (填序号)。
A.1:5,1h,130° B.1:5.5,1h,140°C
C.1:7,2h,160°C D.1:6.5,3h,145°C
(5)TBC与足量NaOH溶液反应的化学方程式: 。
(1)C18H32O7(1分);化学键或官能团(2分);B(1分)
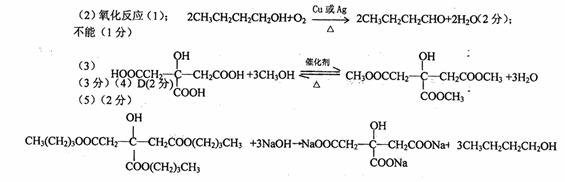
72、(2010届佛山市普通高中高三教学质量检测一,33)
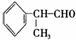
氢化阿托醛是一种重要的化工原料,其合成路线如下:
(1)氢化阿托醛被氧化后的含氧官能团的名称是 。
(2)在合成路线上②③的反应类型分别为② ③ 。
(3)反应④发生的条件是 。
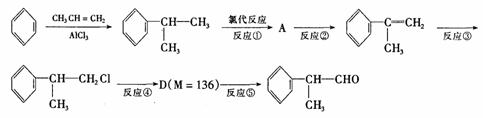
(4)由 反应的化学方程式为 。
(5)1mol氢化阿托醛最多可和______mol氢气加成,1mol氢化阿托醛发生银镜反应可生成__________molAg。
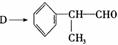
(6)D与有机物X在一定条件下可生成一种相对分子质量为178的酯类物质,则X的结构简式为 。D有多种同分异构体,能满足苯环上有两个取代基,且能使FeCl3溶液显紫色的同分异构体有 种。
(1)羧基…………(2分) (2)消去反应 加成反应……………(各1分共2分)
(3)NaOH溶液加热……………(2分)
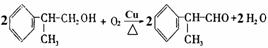
(4) ……………………………(2分)
(5)4 ; 2 (6)CH3COOH ; 6 ……………………………… (以上每空2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com