
4. Will you see to ________ that you will take good care of my car while using it? A. this B. it C. that D. him
3. _____ every day, the Internet provides readers with the latest news from all corners of the
world.
A. Update B. To update C. Updating D. Updated
2. During _______ trip to Yunnan, Premier Wen Jiabao stressed ______importance of water conservation projects and promised more government support.
A. the ;the B. the;不填 C. a;不填 D. a ; the
第一节 单项填空(共15小题;每小题1分,满分15分)
从A、B、C、D四个选项中,选出可以填入空白处的最佳选项,并在答题卡上将该项涂黑。
1. ---Don’t you feel cold, Tim? You wear such a jacket in a day at -5℃. ---___________. I’m boiling. A. No worry B. Take it easy C. Not in the least D. That’s OK
30.(18分)实验设计:给你50粒黄色豌豆、50粒绿色豌豆、50粒皱皮豌豆、50粒光皮豌豆,4个大烧杯,数个培养皿。请利用它们设计实验演示基因的自由组合现象(只演示F1杂合体自交产生F2的过程)。
(1)将4个大烧杯编号为1、2、3、4。
(2)在1号大烧杯上标上雌蕊,装入25粒黄色豌豆(代表基因A)和25粒绿色豌豆(代表基因a),在2号大烧杯上标上雌蕊,装入25粒皱皮豌豆(代表基因B)和25粒光皮豌豆(代表基因b),摇匀后备用。
(3)在3号大烧杯上标上雄蕊,装入 ,在4号大烧杯上___________________,装入25粒皱皮豌豆(代表基因B)和25粒光皮豌豆(代表基因b),摇匀后备用。
(4)分别从1号烧杯和2号烧杯中各取一粒豌豆,这两粒豌豆的组合代表 ,做好记录。
(5)分别从3号烧杯和4号烧杯中各取一粒豌豆,这两粒豌豆的组合代表 ,做好记录。
(6)将这四粒豌豆合在一起,表示__________________________________________这次记录的结果示新个体的基因型。
(7) ,重复上述步骤若干次。
(8)请设计一张表格记录实验结果。
(9)最后统计各种基因组合的卵细胞的比例、________________________________、以及 ,看是否符合自由组合定律。
29.Ⅰ.(16分)2009年12月7-18日在丹麦首都哥本哈根召开世界气候大会,中国政府作出了降低国内单位生产总值二氧化碳排放量的承诺,到2020年中国国内单位生产总值二氧化碳排放量比2005年下降40%一50%,低碳经济与绿色生活方式引起人们重视。
根据下图回答问题:
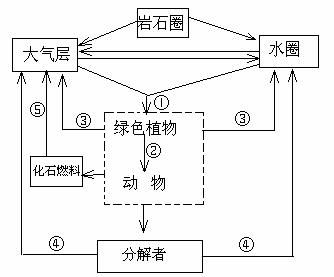
(1)碳从无机环境中进入生物群落的途径①表示的是 过程,生物群落中的碳返回无机环境 的途径为图中的 (填数字序号)。
(2)垃圾资源化、无害化是绿色城市的重要标志之一,可将回收后无法直接利用的有机废物进行发酵处理,该过程所利用的生物属于生态系统的 成分。
 (3)煤是“高碳”能源,通过燃烧。碳主要以 的形式进入大气圈。根据上图提出一项实现“低碳”承诺、减少温室效应的关键措施 。
(3)煤是“高碳”能源,通过燃烧。碳主要以 的形式进入大气圈。根据上图提出一项实现“低碳”承诺、减少温室效应的关键措施 。
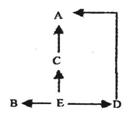
(4)若上图虚线框中的种群及相互间的关系如右图所示,假设E种群中的能量是5.8×109kJ;B种群中的能量为1.3×108kJ。若能量的传递效率为10%-20%,则A种群中的能量至少是 kJ。
(5)当我们通过标记重捕法对种群A进行种群数量的调查时应该注意两次捕抓间隔时间不能太长以及 、 等。
Ⅱ.(10分)在研究生物的呼吸作用过程中经常要测定呼吸商(RQ= )。测定发芽种子呼吸商的装置如下图。
)。测定发芽种子呼吸商的装置如下图。
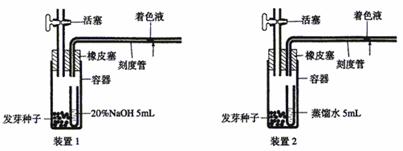
关闭活塞,在25℃下经20分钟读出刻度管中着色液移动距离。设装置1和装置2的着色液分别向左移动x和y(mm)。x和y值反映了容器内气体体积的减少。请回答:
(1)x代表 值,y代表 值。若测得x=200(mm),y=30(mm),则该发芽种子的呼吸商是 。假设该种子呼吸作用的底物是葡萄糖,则此时植物的呼吸作用方式是 。
(2)若要测定已长出一片真叶幼苗的RQ值,则应将该装置放于何种条件下进行,为什么? 、 。(2分)
(3)若将装置1中的氢氧化钠溶液换成碳酸氢钠溶液(二氧化碳浓度保持稳定)而且将萌发的种子换成幼苗,那么在什么情况下着色液会向右移动?为什么? 、 。(2分)
28.(14分)下列框图中A、F、G、H都是芳香族化合物。A的相对分子质量不超过200,完全燃烧只生成CO2和H2O;A中氧元素的质量分数为8/30。
又已知:①G、E均能发生银镜反应;
②F与FeCl3溶液不显紫色。
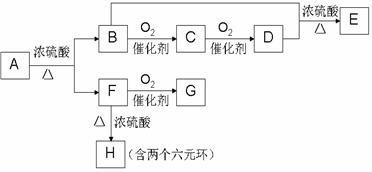
回答下列问题:
(1)F分子中含有的官能团的名称是: 。
(2)由F转化成H的反应类型属于(选填序号) 。
①氧化反应 ②还原反应 ③加成反应 ④取代反应
(3)一个A的分子中应有 个(选填2,3,4,…)氧原子,作出此判断的理由是:
。
(4)F的结构简式可能为: 。
(5)写出B+D→E的化学方程式: 。
(6)H的同分异构体甚多。请写出符合下列条件的同分异构体的结构简式(任写三种):
①苯环上只有一个取代基; ②能够与NaOH溶液反应。
。
27.(15分)CoCl2·6H2O是一种饲料营养强化剂。以含钴废料(含少量Fe、Al等杂质)制取CoCl2·6H2O的一种新工艺流程如下图:
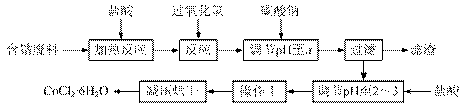
已知:
①钴与盐酸反应的化学方程式为:Co+2HCl=CoCl2+H2↑
②CoCl2·6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴。NaCl熔点801℃,易溶于水、难溶于乙醚等。
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
|
沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Co(OH)2 |
Al(OH)3 |
|
开始沉淀 |
2.3 |
7.5 |
7.6 |
3.4 |
|
完全沉淀 |
4.1 |
9.7 |
9.2 |
5.2 |
请回答下列问题:
⑴在上述新工艺中,用“盐酸”代替原工艺中“盐酸与硝酸的混酸”直接溶解含钴废料,其主要优点为(写出二点) 、 。
⑵加入碳酸钠调节pH至a,a的范围是 。
⑶操作Ⅰ包含3个基本实验操作,它们是 和过滤。
⑷制得的CoCl2·6H2O需减压烘干的原因是 。
⑸为测定产品中CoCl2·6H2O含量,某同学将一定量的样品溶于水,再向其中加入足量的AgNO3溶液,过滤,并将沉淀烘干后称量其质量。通过计算发现产品中CoCl2·6H2O的质量分数大于100%,其原因可能是(写出二点) 、 。
⑹在实验室中,为了从上述产品中获得更纯净的CoCl2·6H2O,采用的方法是 。
26.(14分)氨气在农业和国防工业都有很重要的作用,历史上诺贝尔化学奖曾经有3次颁给研究氮气与氢气合成氨的化学家。
⑴如图表示了298K时氮气与氢气合成氨反应过程中的能量变化,据此请回答:
 ①写出氮气与氢气合成氨的热化学反应方程式: 。
①写出氮气与氢气合成氨的热化学反应方程式: 。
②对于合成氨的反应下列说法正确的是
(填编号)。
A.该反应在任意条件下都可以自发进行
B.加入催化剂,能使该反应的E和△H都减小
C.若该反应在298K、398K时的化学平衡常数
分别为K1、K2,则K1>K2
D.该反应属于人工固氮
⑵现在普遍应用的工业合成氨的方法是哈伯于
1905年发明的,但此法达到平衡时反应物的转
化率不高。
①为了能使该反应的反应速率增大,且平衡向正反应方向移动的措施是 。
A.使用的更高效催化剂 B.升高温度
C.及时分离出氨气 D.充入氮气,增大氮气的浓度(保持容器体积不变)
已知合成氨反应在某温度下2.00L的密闭容器中进行。得如下数据:
|
时间(h) 物质的量(mol) |
0 |
1 |
2 |
3 |
4 |
|
N2 |
1.50 |
n1 |
1.20 |
n3 |
1.00 |
|
H2 |
4.50 |
4.20 |
3.60 |
n4 |
3.00 |
|
NH3 |
0.00 |
0.20 |
n2 |
1.00 |
1.00 |
根据表中数据计算:
②反应进行到2小时时放出的热量为 KJ。
③0~1小时内N2的平均反应速率
④此条件下该反应的化学平衡常数K= (保留两位小数)。
⑤反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1mol,化学平衡向 方向移动(填“正反应”或“逆反应”或“不移动”)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com