
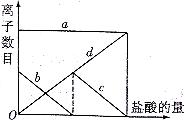
35、(2010年长春市高中毕业班第一次调研测试,13)向一定量的K2CO3溶液中缓慢滴加稀盐酸,并不断搅拌。随着盐酸的加入,溶液中各离子数目也相应地发生变化。溶液中各离子数目与图中四条曲线的对应关系完全正确的是
|
|
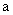 |
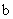 |
 |
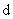 |
|
A |
 |
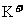 |
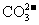 |
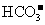 |
|
B |
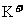 |
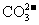 |
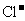 |
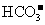 |
|
C |
 |
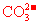 |
 |
 |
|
D |
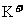 |
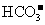 |
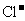 |
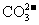 |
34、(江苏省江浦高级中学2010届高三模块复习,12)今有室温下四种溶液,有关叙述不正确的是
|
|
① |
② |
③ |
④ |
|
pH |
11 |
11 |
3 |
3 |
|
溶液 |
氨水 |
氢氧化钠溶液 |
醋酸 |
盐酸 |
A.①、②中分别加入适量的氯化铵晶体后,两溶液的pH均减小
B.分别加水稀释10倍,四种溶液的pH ①>②>④>③
C.①、④两溶液等体积混合,所得溶液中c(Cl-)>c(NH4+)>c(OH-)>c(H+)
D.VaL④与VbL②溶液混合后,若混合后溶液pH=4, 则Va ∶Vb= 11∶9
高频考点十一 元素及其化合物
33、(2010届佛山市普通高中高三教学质量检测一,23)下列叙述正确的是
A.c(NH4+)相等的(NH4)2SO4、(NH4)2Fe(SO4)2和NH4Cl溶液中,溶质浓度大小关系是:c[(NH4)2Fe(SO4)2] < c[(NH4)2SO4] < c(NH4Cl)
B.无色透明的酸性溶液中,Cu2+、K+、SO42-、NO3- 能大量共存
C.0.2mol·L-1 HCl溶液与等体积0.05 mol·L-1 Ba(OH)2溶液混合后,溶液的pH=1
D.NaHCO3溶液中:c(H+) + c(H2CO3)=c(CO32-) + c(OH-)
32、(2010年温州市高三第一次适应性测试,9)下列事实与结论相符且正确的是
A.100mL 0.1mol·L-1 AlCl3溶液中含有Al3+数目为0.01NA(NA代表阿伏加德罗常数)
B.Ksp(BaSO4)=1.07×10-10,Ksp(BaCO3)=2.58×10-9,所以不能将BaSO4转化为BaCO3
C.常温下,pH=11的NaOH溶液和pH=3的CH3COOH溶液等体积混合后,溶液pH<7
D.0.1 mol·L-1 Na2CO3溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
31、(山东省潍坊市2010届高三教学质量抽样检测C,16)在溶液中有浓度均为0.01mol·L-1的Fe3+、Cr3+、Zn2+、Mf2+等离子,已知:
Ksp[Fe(OH)3]=2.6×10-39mol4·L-4;Ksp[Cr(OH)3]=7.0×10-31mol4·L-4
Ksp[Zn(OH)2]=1.0×10-17mol3·L-3;Ksp[Mg(OH)2]=1.8×10-11mol3·L-3
当氢氧化物开始沉淀时,下列哪一种离子所需溶液的pH最小 ( )
A.Fe3+ B.Cr3+ C.Zn2+ D.Mg2+
30、(安徽省合肥市2010年高三第一次教学质量检测,16
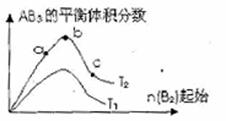 )某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)
)某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g) 2AB2(g)化学平衡状态的影响,得到如右图所示的变化规律(图中T表示温度,n表示物质的量),据此可得出的判断结论不正确的是 ( )
2AB2(g)化学平衡状态的影响,得到如右图所示的变化规律(图中T表示温度,n表示物质的量),据此可得出的判断结论不正确的是 ( )
A.达到平衡时A2的转化率大小为:b>a
B.a、b、c三点的平衡常数相同
C.若T2>T1,则正反应一定是吸热反应
D.b点时,平衡体系中A、B原子数之
比一定是1:1
高频考点十 溶液中的离子平衡问题
29、(福建省上杭一中、武平一中、长汀一中2010届高三上学期期末联考,15)用于净化汽车尾气的反应:2NO(g)+2CO(g) 2CO2(g)+N2(g),已知该反应速率极慢,570K时平衡常数为1×1059。下列说法正确的是
2CO2(g)+N2(g),已知该反应速率极慢,570K时平衡常数为1×1059。下列说法正确的是
A. 装有尾气净化装置的汽车排出的气体中不再含有NO或CO
B. 提高尾气净化效率的常用方法是升高温度
C. 提高尾气净化效率的最佳途径是研制高效催化剂
D. 570K时该反应正向进行的程度很大,故使用催化剂并无实际意义
28、(2010届无锡市普通高中高三质量调研,11)在某体积固定的密闭容器中进行如下可逆反应:A(g)+B(g) 2C(g),在反应过程中体系的温度持续升高,实验测得混合气体中C的含量与温度关系如图所示。下列说法正确的是
2C(g),在反应过程中体系的温度持续升高,实验测得混合气体中C的含量与温度关系如图所示。下列说法正确的是
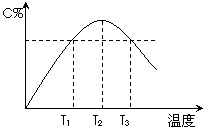 A.此反应的正反应是吸热反应
A.此反应的正反应是吸热反应
B.反应在T2温度时达到平衡
C.T3温度时正反应速率大于逆反应速率
D.T3温度时正反应速率大于T1温度时正反应速率
27、(福建省永春一中、培元中学、季延中学、石光华侨联中2010届高三上学期期末联考,12)著名化学家徐光宪获得2008年度“国家最高科学技术奖”,以表彰他在稀土串级萃取理论方面作出的贡献。稀土铈(Ce)元素主要存在于独居石中,金属铈在空气中易氧化变暗,受热时燃烧,遇水很快反应。已知:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+。下列说法不正确的是( )
A.铈的冶炼步骤为:用稀土串级萃取法对矿石进行筛选富集;电解熔融CeO2。
B.CeO2溶于氢碘酸的化学方程式可表示为:CeO2+4HI=CeI4+2H2O
C.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++Fe2+=Ce3++Fe3+
D.四种稳定的核素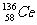 、
、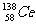 、
、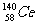 、
、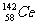 ,它们互称为同位素
,它们互称为同位素
高频考点九 化学反应速率和化学平衡
26、(山东省实验中学2010届高三第二次诊断性测试,14)将0.2molAgNO3、0.4molCu(NO3)2、0.6molKCl溶于水,配成100mL溶液,用惰性电极电解一段时间后,若在一极析出0.3molCu,此时在另一极上产生的气体体积(标准状况)为
A.4.48L B.5.6L C.6.72L D.7.84L
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com