
12.(2010陕西文数)已知向量a=(2,-1),b=(-1,m),c=(-1,2)若(a+b)∥c,则
m= -1 .
解析: ,所以m=-1
,所以m=-1
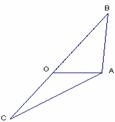 (2010江西理数)13.已知向量
(2010江西理数)13.已知向量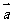 ,
, 满足
满足 ,
, ,
, 
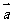 与
与

 的夹角为60°,则
的夹角为60°,则
[答案] 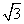
[解析]考查向量的夹角和向量的模长公式,以及向量三角形法则、余弦定理等知识,如图 ,由余弦定理得:
,由余弦定理得:
(2010浙江文数) (17)在平行四边形ABCD中,O是AC与BD的交点,P、Q、M、N分别是线段OA、OB、OC、OD的中点,在APMC中任取一点记为E,在B、Q、N、D中任取一点记为F,设G为满足向量
(17)在平行四边形ABCD中,O是AC与BD的交点,P、Q、M、N分别是线段OA、OB、OC、OD的中点,在APMC中任取一点记为E,在B、Q、N、D中任取一点记为F,设G为满足向量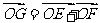 的点,则在上述的点G组成的集合中的点,落在平行四边形ABCD外(不含边界)的概率为
的点,则在上述的点G组成的集合中的点,落在平行四边形ABCD外(不含边界)的概率为 。
。

答案: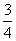
(2010浙江文数)(13)已知平面向量 则
则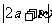 的值是
的值是
答案 :
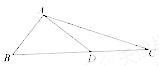 (2010天津理数)(15)如图,在
(2010天津理数)(15)如图,在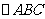 中,
中, ,
,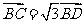 ,
,
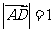 ,则
,则
 .
.
[答案]D
[解析]本题主要考查平面向量的基本运算与解三角形的基础知识,属于难题。

[解析]近几年天津卷中总可以看到平面向量的身 影,且均属于中等题或难题,应加强平面向量的基本运算的训练,尤其是与三角形综
影,且均属于中等题或难题,应加强平面向量的基本运算的训练,尤其是与三角形综 合的问题。
合的问题。
13.(2010上海文数)在平面直角坐标系中,双曲线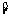 的中心在原点,它的一个焦点坐标为
的中心在原点,它的一个焦点坐标为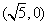 ,
,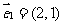 、
、 分别是两条渐近线的方向向量。任取双曲线
分别是两条渐近线的方向向量。任取双曲线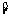 上的点
上的点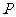 ,若
,若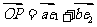 (
( 、
、 ),则
),则
 、
、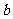 满足的一个等式是 4ab=1
。
满足的一个等式是 4ab=1
。
解析:因为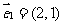 、
、 是渐进线方向向量,所以双曲线渐近线方程为
是渐进线方向向量,所以双曲线渐近线方程为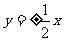 ,又
,又
双曲线方 程为
程为 ,
,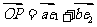 =
=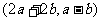 ,
,
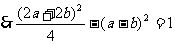 ,化简得4ab=1
,化简得4ab=1
(20 10浙江理数)(16
10浙江理数)(16 )已
)已 知平面向量
知平面向量 满足
满足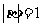 ,且
,且 与
与 的夹角为120°,则
的夹角为120°,则 的取值范围是__________________ .
的取值范围是__________________ .
解析:利用题设条件及其几何意义表示在三角形中,即可迎刃而解,本题主要考察了平面向量的四则运算及其几何意义,突出考察了对问题的转 化能力和数形结合的能力,属中档题。
化能力和数形结合的能力,属中档题。
27. (1)甲、乙两种元素是同一周期的相邻元素,甲元素是形成有机物的主要元素,乙元素的p亚层上有3个电子。
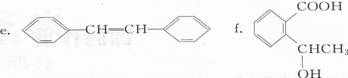
写出甲元素原子的核外电子排布式 。下列各化合物分子中甲元素的原子轨道杂化方式全部相同的是 (填序号)。
a.CH2=CH-C≡CH b.CH2=C(CH3)一CH=CH2 C.C(CH2OH)4

(2)下列现象和应用与电子跃迁无关的是( ).
A.激光 B.焰色反应 C.燃烧放热 D.原子光谱 E.霓虹灯 F.石墨导电
(3)A、B、C三种短周期元素,A是原子半径最小的元素,B原子最外层电子数是次外层的两倍,C元素的基态原子L层有两个未成对电子.
①某直线形分子由A、B两种元素组成且原子个数比为l:1,该分子中含有 个σ键, 个∏键.
②由A、B、C三种元素组成的无机阴离子,可形成二聚离子或多聚链状离子,从该阴离子的结构特点分析能够相互缔合的原因:
(4)CO的结构式可表示为C≡0.N2的结构式可表示为N≡N.下表是两者的键能数据:(单位:kJ·mol_。)
|
|
A-B |
A=B |
A≡B |
|
C≡0 |
357.7 |
798.9 |
1071.9 |
|
N≡N |
154.8 |
418.4 |
941.7 |
结合数据说明CO比N2活泼的原因:
(5)Fe、Co、Ni、Cu等金属能形成配合物与这些金属原子的电子层结构有关.
①Fe(CO)5常温下呈液态.熔点为一20.5℃.沸点为 103℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于 (填晶体类型).
②CuSO5·5H20(胆矾)中含有水合铜离子因而呈蓝色.写出胆矾晶体中水合铜离子的结构简式(必须将配位键表示出来)
26.已知和碳元素同主族的X元素位于周期表中的第1个长周期,短周期元素Y原子的最外层电子数比内层电子总数少3,它们所形成化合物的分子式是XY4。试回答:
(1)X元素的原子基态时电子排布式为 ;Y元素原子最外层电子的电子排布图为 。
(2)该化合物的空间结构为 ,中心原子的杂化类型为 ,
(3)该化合物在常温下为液体,该化合物中分子间作用力是 。
(4)该化合物的沸点与SiCl4比较, (填化学式)的高,原因是 .
25.Q、R、X、Y、Z为前20号元素中的五种,Q的低价氧化物与X单质分子的电子总数相等,R与Q同族,Y和Z的离子与Ar原子的电子结构相同且Y的原子序数小于Z。
(1)Q的最高价氧化物,其固态属于 晶体,俗名叫 ;
(2)R的氢化物分子的空间构型是 ,属于 分子(填“极性”或“非极性”);它与X 形成的化合物可作为一种重要的陶瓷材料,其化学式是 ;
(3)X的常见氢化物的空间构型是 ;它的另一氢化物X2H4是一种火箭燃料的成分,其电子式是 ;
(4)Q分别与Y、Z形成的共价化合物的化学式是 和 ;Q与Y形成的分子的电子式是 ,属于 分子(填“极性”或“非极性”)。
24. X、Y、Z、W为按原子序数由小到大排列的四种短周期元素,已知:
①X元素原子价电子排布为nS2np2,且原子半径是同族元素中最小的。
②Y元素是地壳中含量最多的元素;w元素的电负性略小于Y元素,在w原子的电子排布中,p轨道上只有1个未成对电子。
③Z元素的电离能数据见下表(kJ·mol_):
|
Ⅰ1 |
Ⅰ2 |
Ⅰ3 |
Ⅰ4 |
… |
|
496 |
4562 |
6912 |
9540 |
… |
请回答:
(1)Z2Y2的电子式为 ,含有的化学键类型为 ,Z2Y2为 晶体。
(2)X、Y、Z三种元素所形成的常见化合物的名称为 ;XY2的结构式为 ,分子空间构型为

(3)X、Y、Z、W四种元素所形成的单质中,熔点最高、硬度最大的是 (填“名称”);晶体ZW的熔点比晶体XW4明显高的原因是 。
(4)ZW晶体的结构示意图如下。已知ρ(ZW)=2.2 g·cm 一3,NA=6.02×1023 mol-,则ZW晶体中两个最近的Z离子中心间的距离为 。
23.人们对苯及芳香烃的认识有一个不断深化的过程。
(1)已知分子式为C6H6的结构有多种,其中的两种为

①这两种结构的区别表现在:定性方面(即化学性质方面):Ⅱ能 (选填a、b、c、
d)而Ⅰ不能。
a.被酸性高锰酸钾溶液氧化
b.能与溴水发生加成反应
c.能与溴发生取代反应
d.能与氢气发生加成反应
 定量方面(即消耗反应物的量的方面):1 mol C6H6与H2加成时:I需
mol,而Ⅱ
定量方面(即消耗反应物的量的方面):1 mol C6H6与H2加成时:I需
mol,而Ⅱ
需 mol。
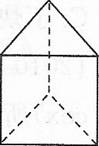
②今发现C6H6还可能有另一种立体结构(如图):该结构的二氯代物
有 种。
(2)萘也是一种芳香烃,它的分子式是C10 H8,请你判断,它的结构简式可能是下列中的
(填入编号)

(3)根据第(3)小题中你判断得到的萘结构简式,它不能解释萘的下列 事实(填入编号)。
a.萘不能使溴的四氯化碳溶液褪色 b.萘能与H2发生加成反应
c.萘分子中所有原子在同一平面上 d.一溴代萘(C10H7Br)只有两种
(4)现代化学认为萘分子碳碳之间的键是 。
22.汽油不仅是最重要的燃料,而且是重要的化工原料,它既可以裂解得到气态化工原料如乙烯等,还可以在催化剂催化作用下改变分子结构,由链烃变成芳香烃,如己烷变成苯。这个变化叫异构化。请根据以汽油为原料的下列衍变关系,写出相应的化学方程式,并注明反应类型。
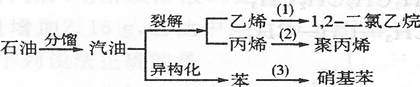
(1)
(2)
(3)
(4)写出1,2-二氯乙烷完全水解的方程式:
21.某高聚物的结构式如下图所示:

合成该有机物的物质为( )
A.2一甲基一1,3一戊二烯和乙烯
B.2,4一二甲基一1,3一己二烯
C.2一甲基一1,3一丁二烯和丙烯
D.2,4一二甲基一2一己烯
20.现有四种元素的基态原子的电子排布式如下:
①ls22s22p63s23p4 ②ls22s22p63s23p3③ls22s22p3 ④ls22s22p5
则下列有关比较中正确的是 ( )
A.第一电离能:④>③>②>①
B.原子半径:④>③>②>①
C.电负性:④>③>②>①
D.最高正化合价:④>③=②>①
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com