
37. (8分)[物理-物理3-4]
(8分)[物理-物理3-4]
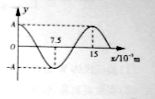
(1)渔船常利用超声波来探测远处鱼群的方位。已知某超声波频率快为1.0×105 HZ,某时刻该超声波在水中传播的波动图象如图所示。
①从该时刻开始计时,画出x=7.5×10-3m处质点做简谐运动的振动图象(至少一个周期)。
②现测得超声波信号从渔船到鱼群往返一次所用时间为4s,求鱼群与渔船间的距离(忽略船和鱼群的运动)。
(2)如图所示,一段横截面为正方形的玻璃棒,中间部分弯成四分之一圆弧形状,一细束单色光由MN端面的中点垂直射入,恰好能在弧面EF上发生全反射,然后垂直PQ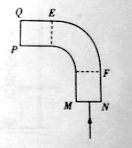 端面射出。
端面射出。
①求该玻璃棒的折射率。
②若将入射光向N端平移,当第一次射到弧面EF上时______(填“能”“不能”或“无法确定能否”)发生全反射。
36.(8分)[物理-物理3-3]
一太阳能空气集热器,底面及侧面为隔热材料,顶面为透明玻璃板,集热器容积为V0,开始时内部封闭气体的压强为p0。经过太阳暴晒,气体温度由T0=300K升至T1=350K。

(1)求此时气体的压强。
(2)保持T1=350K不变,缓慢抽出部分气体,使气体压强再变回到p0。求集热器内剩余气体的质量与原来总质量的比值。判断在抽气过程中剩余气体是吸热还是放热,并简述原因。
35.(8分)[生物-现代生物科技专题]
胚胎工程是一项综合性的动物繁育技术,可在畜牧业和制药业等领域发挥重要作用。下图是通过胚胎工程培育试管牛的过程。

(1)从良种母牛采集的乱母细胞,都需要进行体外培养,其目的是 ;从良种公牛采集的精子需 后才能进行受精作用。K^S*5U.C#O%下
(2)在体外培养受精卵时,除了给予一定量的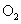 以维持细胞呼吸外,还需要提供
以维持细胞呼吸外,还需要提供
气体以维持 。
(3)图中过程A称为 ,它在胚胎工程中的意义在于 。
(4)研制能够产生人类白细胞介素的牛乳腺生物反应器,需将目的基因导入牛受精卵,最常用的导入方法是 ;获得转基因母牛后,如果 即说明目的基因已经表达。
34.(8分)[生物--生物技术实践]
生物柴油是一种可再生清洁能源,其应用在一定程度上能够缓人类对化石燃料的消耗。科学家发现,在微生物M产生的脂肪酶作用下,植物油与甲醇反应能够合成生物柴油(如下图)。K^S*5U.C#O%下
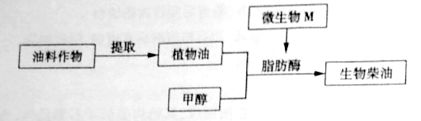
⑴用于生产生物些油的植物油不易挥发,宜选用 、 方法从油料作物中提取。
⑵筛选产脂肪酶的微生物M时,选择培养基中添加的植物油为微生物生长提供 ,培养基灭菌采用的最适方法是
法。K^S*5U.C#O%下
⑶测定培养液中微生物数量,可选用 法直接计数;从微生物M分离提取的脂肪酶通常需要检测 ,以确定其应用价值;为降低生产成本,可利用 技术使脂肪酶能够重复使用。
⑷若需克隆脂肪酶基因,可应用耐热DNA聚合酶催化的 技术。
33.(8分)[化学--有机化学基础]K^S*5U.C#O%下
利用从冬青中提取出的有机物A合成抗结肠炎药物Y及其他化学品,合成路线如下图:

根据上述信息回答:
(1)D不与NaHC 溶液反应,D中官能团的名称是______,B
溶液反应,D中官能团的名称是______,B C的反应类型是____。
C的反应类型是____。
(2)写出A生成B和E的化学反应方程式______。K^S*5U.C#O%下
(3)A的同分异构体I和J是重要的医药中间体,在浓硫酸的作用下I和J分别生产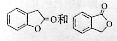 ,鉴别I和J的试剂为_____。
,鉴别I和J的试剂为_____。
(4)A的另一种同分异构体K用于合成高分子材料,K可由 制得,写出K在浓硫酸作用下生成的聚合物的结构简式_________________。
制得,写出K在浓硫酸作用下生成的聚合物的结构简式_________________。
32.(8分)[化学----物质结构与性质]
碳族元素包括C、Si、Ge、Sn、Pb。
(1)碳纳米管由单层或多层石墨层卷曲而成,其结构类似于石墨晶体,每个碳原子通过___________杂化与周围碳原子成键,多层碳纳米管的层与层之间靠________结合在一起。
(2)C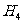 中共用电子对偏向C,Si
中共用电子对偏向C,Si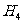 中共用电子对偏向H,则C、Si、H的电负性由大到小的顺序为____________。
中共用电子对偏向H,则C、Si、H的电负性由大到小的顺序为____________。
(3)用价层电子对互斥理论推断Sn 分子中Sn-Br键的键角_______120°(填“>”“<”或“=”)
分子中Sn-Br键的键角_______120°(填“>”“<”或“=”)
(4)铅、钡、氧形成的某化合物的晶胞结构是: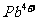 处于立方晶胞顶点,
处于立方晶胞顶点,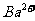 处于晶胞中心,
处于晶胞中心,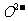 处于晶胞棱边中心。该化合物化学式为________,每个
处于晶胞棱边中心。该化合物化学式为________,每个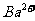 与_______个
与_______个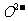 配位。
配位。
31.(8分)[化学-----化学与技术]
玻璃钢可由酚醛树脂和玻璃纤维制成。
(1)酚醛树脂有苯酚和甲醛缩聚而成,反应有大量热放出,为防止温度过高,应向已有苯酚的反应釜中____加入甲醛,且反应釜应装有____装置。K^S*5U.C#O%下
(2)玻璃纤维由玻璃拉丝得到。普通玻璃是由石英砂、______和石灰石(或长石)高温熔融而成,主要反应的化学方程式为_____________________________________。
(3)玻璃钢中玻璃纤维的作用是__________。玻璃钢具有___________等优异性能(写出亮点即可)。
(4)下列处理废旧热固性酚醛塑料的做法合理的是_________。
a.深埋 b.粉碎后用作树脂填料
c.用作燃料 d.用有机溶剂将其溶解,回收树脂
30.(16)聚合硫酸铁又称聚铁,化学式为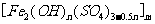 ,广泛用于污水处理。实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4·7H2O )过程如下:
,广泛用于污水处理。实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4·7H2O )过程如下:
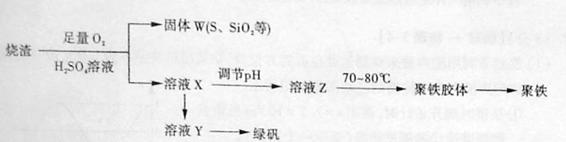
(1)验证固体W焙烧后产生的气体含有SO2 的方法是_____。
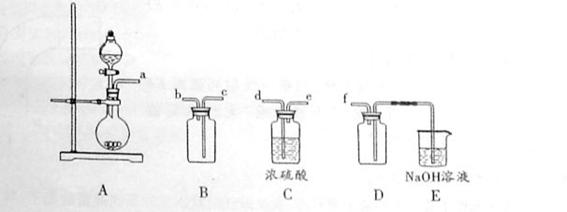
(2)实验室制备、收集干燥的SO2 ,所需仪器如下。装置A产生SO2 ,按气流方向连接各仪器接口,顺序为a



 f装置D的作用是_____,装置E中NaOH溶液的作用是______。
f装置D的作用是_____,装置E中NaOH溶液的作用是______。
(3)制备绿矾时,向溶液X中加入过量_____,充分反应后,经_______操作得到溶液Y,再经浓缩,结晶等步骤得到绿矾。K^S*5U.C#O%下
(4)溶液Z的pH影响聚铁中铁的质量分数,用pH试纸测定溶液pH的操作方法为______。若溶液Z的pH偏小,将导致聚铁中铁的质量分数偏_______。
[选作部分]
29.(12分)对金属制品进行抗腐蚀处理,可延长其使用寿命。
(1)以下为铝材表面处理的一种方法:

①碱洗的目的是除去铝材表面的自然氧化膜,碱洗时常有气泡冒出,原因是______(用离子方程式表示)。为将碱洗槽液中铝以沉淀形式回收,最好向槽液中加入下列试剂中的______.。
a.NH3 b.CO2 c.NaOH d.HNO3
②以铝材为阳极,在H2SO4 溶液中电解,铝材表面形成氧化膜,阳极电极反应为____。取少量废电解液,加入NaHCO,溶液后产生气泡和白色沉淀,产生沉淀的原因是_____。
 (2)镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨作阳极的原因是______。
(2)镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨作阳极的原因是______。
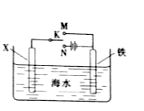
(3)利用右图装置,可以模拟铁的电化学防护。
若X为碳棒,为减缓铁的腐蚀,开关K应置于______处。
若X为锌,开关K置于M处,该电化学防护法称为_______。
28.(14分)硫一碘循环分解水制氢主要涉及下列反应:
Ⅰ SO2+2H2O+I2===H2SO4+2HI
Ⅱ 2HI H2+I2
H2+I2
Ⅲ 2H2SO42===2SO2+O2+2H2O
(1)分析上述反应,下列判断正确的是 。
a.反应Ⅲ易在常温下进行 b.反应Ⅰ中 氧化性比HI强
氧化性比HI强
c.循环过程中需补充H2O d.循环过程中产生1mol O2的同时产生1mol H2
(2)一定温度下,向1L密闭容器中加入1mol HI(g),发生反应Ⅱ,H2物质的量随时间的变化如图所示。
0~2 min内的平均放映速率v(HI)=
。该温度下,H2(g)+I2(g) 2HI(g)的平衡常数K= 。
2HI(g)的平衡常数K= 。
相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则 是原来的2倍。
a.平衡常数 b.HI的平衡浓度 c.达到平衡的时间 d.平衡时H2的体积分数
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡 移动(填“向左”“向右”或者“不”);若加入少量下列试剂中的 ,产生H2的速率将增大。
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
(4)以H2为燃料可制成氢氧燃料电池。
已知 2H2(g)+O2(g)===2H2O(I) △H=-572KJ.mol-1
某氢氧燃料电池释放228.8KJ电能时,生成1mol液态水,该电池的能量转化率-为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com