
3.对于pH相同的强酸和弱酸(或强碱和弱碱)溶液稀释相同的倍数,强酸(或强碱)溶液的pH变化幅度大。这是因为强酸(或强碱)已完全电离,随着加水稀释,溶液中H+(或OH-)数(除水电离的以外)不会增多,而弱酸(或弱碱)随着加水稀释,电离程度增大,H+(或OH-)数会增多。
2.弱酸、弱碱的稀释
在稀释过程中有浓度的变化,又有电离平衡的移动,不能求得具体数值,只能确定其pH范围。
例如:(1)pH=3的CH3COOH溶液,稀释100倍,稀释后3<pH<5;
(2)pH=10的NH3·H2O溶液,稀释100倍,稀释后8<pH<10;
(3)pH=3的酸溶液,稀释100倍,稀释后3<pH≤5;
(4)pH=10的碱溶液,稀释100倍,稀释后8≤pH<10。
1.强酸、强碱的稀释
在稀释时,当它们的浓度大于10-5mol·L-1时,不考虑水的电离;当它们的浓度小于10-5mol·L-1时,应考虑水的电离。
例如:(1)pH=6的HCl溶液稀释100倍,混合液pH≈7(不能大于7);
(2)pH=8的NaOH溶液稀释100倍,混合液pH≈7(不能小于7);
(3)pH=3的HCl溶液稀释100倍,混合液pH=5;
(4)pH=10的NaOH溶液稀释100倍,混合液pH=8。
5.利用元素周期律进行判断,如非金属性Cl>S>P>Si,则酸性HClO4>H2SO4>H3PO4>H2SiO3(最高价氧化物对应水化物);金属性:Na>Mg>Al,则碱性:NaOH>Mg(OH)2>Al(OH)3。
考点二、强酸与弱酸(或强碱与弱碱)的比较
|
|
等物质的量浓度的盐酸(a)与醋酸(b) |
等pH的盐酸(a)与醋酸(b) |
|
pH或物质 的量浓度 |
pH:a<b |
物质的量浓度:a<b |
|
溶液导电性 |
a>b |
a=b |
|
水的电离程度 |
a<b |
a=b |
|
c(Cl-)与c(CH3COO-)大小 |
c(Cl-)> c(CH3COO-) |
c(Cl-)= c(CH3COO-) |
|
等体积溶液中和NaOH的量 |
a=b |
a<b |
|
分别加该酸的钠盐固体后pH |
盐酸:不变 醋酸:变大 |
盐酸:不变 醋酸:变大 |
考点三、酸碱稀释时pH的变 化
化
4.利用较强酸(碱)制备较弱酸(碱)判断电解质强弱。如将醋酸加入碳酸钠溶液中,有气泡产生。说明酸性:CH3COOH>H2CO3。
3.稀释方面
如图:a、b分别为pH相等的NaOH溶液和氨水稀释曲线。c、d分别为pH相等的 盐酸和醋酸稀释曲线。
盐酸和醋酸稀释曲线。
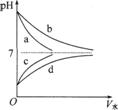
请体会图中的两层含义:
(1)加水稀释相同倍数后的pH大小:氨水>NaOH溶液,盐酸>醋酸。若稀释10n倍,盐酸、NaOH溶液pH变化n个单位,而氨水与醋酸溶液pH变化不到,n个单位。
(2)稀释后的pH仍然相等,则加水量的大小:氨水NaOH溶液,醋酸>盐酸。
2.水解方面
根据电解质越弱,对应离子水解能力越强
(1)CH3COONa水溶液的pH>7;
(2)0.1 mol·L-1 CH3COONa溶液pH比0.1 mol·L-1 NaCl溶液大。
1.电离方面:不能全部电离,存在电离平衡,如
(1)0.1 mol·L-1CH3COOH溶液pH约为3;
(2)0.1 mol CH3COOH溶液的导电能力比相同条件下盐酸的弱;
(3)相同条件下,把锌粒投入等浓度的盐酸和醋酸中,前者反应速率比后者快;
(4)醋酸溶液中滴入石蕊试液变红,再加CH3COONH4,颜色变浅;
(5)pH=1的CH3COOH与pH=13的NaOH等体积混合溶液呈酸性等。
35.用“候氏制碱法”制得的纯碱中常含有少量的氯化钠。为测定某纯碱样品中碳酸钠的质量分数,小雯同学称取该样品5.6g加入到盛有100g足量稀盐酸的烧杯中,完全反应后称得烧杯中的溶液质量为103.4g。求该纯碱样品中碳酸钠的质量分数。
34.工业上制备铝的化学方程式为 2Al2O3==== 4Al+3O2↑,则由102 g氧化铝制得铝的质量是多少?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com