
5.能彻底水解的离子组,由于水解程度较大,书写时要用" ==="、"↑"、"↓"等,如NaHCO3溶液与AlCl3溶液混合:Al3++3HCO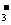 ===Al(OH)3↓+3CO2↑。
===Al(OH)3↓+3CO2↑。
考点七、溶液中微粒浓度的 大小比较
大小比较
4.多元弱碱阳离子的水解方程式一步写完。例如:FeCl3水解:Fe3++3H2O Fe(OH)3+3H+。
Fe(OH)3+3H+。
3.多元弱酸盐的水解分步进行,以第一步为主,一般只写第一步水解的离子方程式。例如:Na2CO3水解:CO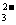 +H2O
+H2O HCO
HCO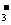 +OH-。
+OH-。
2.盐类水解一般是可逆反应,书写时一般不写"===",而要写" "。
"。
1.在书写盐类水解的离子方程式时一般不标"↑ "或"↓",也不把生成物(如NH3·H2O、H2CO3等)写成其分解产物的形式。
2.影响盐类水解的因素
(1)内因
盐本身的性质是决定盐水解程度大小的最主要因素,组成盐的酸根相对应的酸越弱(或阳离子对应的碱越弱),水解程度就越大。
(2)外因
①温度:盐的水解是吸热反应,因此升高温度,水解程度增大。
②浓度:盐的浓度越小,电解质离子相互碰撞结合成电解质分子的几率越小,水解程度越大。
③外加酸碱:促进或抑制盐的水解。例如:CH3COONa溶液中加强酸,盐的水解程度增大,加强碱,盐的水解程度减小。
④外加盐
a.加入水解后酸碱性相反的盐,盐的水解互相促进;加入水解后酸碱性相同的盐,盐的水解互相抑制。
b.加入不参加水解的固态盐,对水解平衡无影响;加入不参加水解的盐溶液,相当于对原盐溶液稀释,盐的水解程 度增大。
度增大。
外界条件对反应Fe3++3H2O Fe(OH)3+3H+(正反应为吸热反应)的影响如下:
Fe(OH)3+3H+(正反应为吸热反应)的影响如下:
|
条件 |
移动方向 |
H+数 ] |
pH |
Fe3+水解程度 |
现象 |
|
升高温度 |
向右 |
增加 |
降低 |
增大 |
颜色变深(黄 红褐) |
|
通HCl |
向左 |
增加 |
降低 |
减小 |
颜色变浅 |
|
加H2O |
向右 |
增加 |
升高 |
增大 |
颜色变浅 |
|
加镁粉 |
向右 |
减小 |
升高 |
增大 |
红褐色沉淀,无色气体。 |
|
加NaHCO3 |
向右 |
减小 |
升高 |
增大 |
红褐色沉淀,无色气体 |
考点六、水解方程式书写的注意事项
1.盐类水解的规律
规律:有弱才水解,无弱不水解,都弱都水解,越弱越水解,谁虽显谁性,同强显中性。
|
盐的类型 |
实例 |
水解离子 |
溶液的酸碱性 |
|
强酸强碱盐 |
NaCl、KNO3 |
无 |
中性 |
|
强酸弱碱盐 |
NH4Cl、CuSO4、FeCl3 |
NH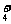 、Cu2+、Fe3+ 、Cu2+、Fe3+ |
酸性 |
|
强碱弱酸盐[ ] |
Na2S、Na2CO3、NaHCO3 |
S2-、CO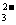 、HCO 、HCO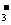 |
碱性 |
|
弱酸弱碱盐 |
(NH4)2CO3、CH3COONH4 |
NH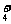 、CO 、CO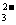 、CH3COO- 、CH3COO- |
由酸碱的相对强弱决定 |
2.具体情况(室温下)
(1)酸、碱溶液pH的计算
①强酸溶液,如HnA,设浓度为c mol·L-1,c(H+)=ncmo·L-1,pH=-lgc(H+)=-lg(nc)。
②强碱溶液,如B(OH)n,设浓度为c mol·L-1,c(H+)=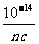 mol ·L-1,pH=lgc(H+)=14+lg(nc)。
mol ·L-1,pH=lgc(H+)=14+lg(nc)。
③一元弱酸溶液,设浓度为c mol·L-1,则有:c(H+)<c mol·L-1,-lgc<pH<7。
④一元弱碱溶液,则为c(OH-)<c mol·L-1,c(H+)> 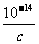 mol·L-1,7<pH<14+lgc。
mol·L-1,7<pH<14+lgc。
(2)酸、碱混合pH计算
①两强酸混合:c混(H+)=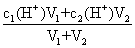
②两强碱混合:c混(OH-)=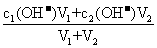
③强酸、强碱混合(一者过量):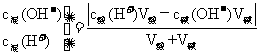
④强酸、强碱的pH之和与H+和OH-浓度比较
pH(酸)+pH(碱)=14,c酸(H+)=碱(OH-)
pH(酸)+pH(碱)<14,c酸(H+)>c碱(OH-)
pH(酸)+pH(碱)>14,c酸(H+)<c碱(OH-)
推导:pH(酸)+pH(碱)=-lg{c酸(H+)·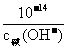 }=14-lg
}=14-lg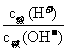 。
。
考点五、盐类水解的规律及影响因素
1.总体原则
(1)若溶液为酸性,先求c(H+),再求pH;
(2)若溶液为碱性,先求c(OH-),再由c(H+)=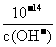 求c(H+),最后求pH。
求c(H+),最后求pH。
4.对于物质的量浓度相同的强酸和弱酸(或强碱和弱碱),稀释相同的倍数,pH的变化幅度不同,强酸(或强碱)稀释后pH变化幅度大。
考点四、溶液pH的计算
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com