
6. 用0.1
mol L-1盐酸分别跟20 mL NaOH溶液及20 mL氨水完全反应,都消耗20 mL盐酸。则NaOH溶液与氨水的关系是 ( )
用0.1
mol L-1盐酸分别跟20 mL NaOH溶液及20 mL氨水完全反应,都消耗20 mL盐酸。则NaOH溶液与氨水的关系是 ( )
A.c(OH-)相同
B.pH相同
C.电离程度相同
D 物质的量浓度相同
解析:由题意可知消耗的HCl的物质 的量相同,所以NaOH与氨水的浓度相等。NaOH完全电离,一水合氨部分电离,所以NaOH溶液中c(OH-)较大,pH较大。
的量相同,所以NaOH与氨水的浓度相等。NaOH完全电离,一水合氨部分电离,所以NaOH溶液中c(OH-)较大,pH较大。
答案:D
5.MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如下图所示。下列叙述中不正确的是 ( )
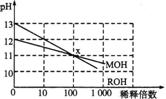
A.ROH是一种强碱
B.在x点,MOH未完全电离
C.在x点,c(M+)=c(R+)[
D.稀释前,c(ROH)=10c(MOH)
4.下列操作会使H2O的电离平衡向正方向移动,且溶液呈酸性的是( )
A.将纯水加热到95℃时,pH<7
B.向水中加少量NaHSO4
C.向水中加少量Na2CO3
D.向水中加少量FeCl3
解析:本题考查外界因素的改变时水的电离平衡的影响,温度升高,促进水的电离,c(H+)=c(OH-)同时增大,pH变小,呈中性;向水中加少量NaHSO4,提供了H+,抑制了水的电离;向水中加少量Na2CO3,CO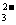 的水解促进了水的电离,溶液呈碱性;Fe3+促进了水的电离,溶液呈酸性。
的水解促进了水的电离,溶液呈碱性;Fe3+促进了水的电离,溶液呈酸性。
答案:D
3.在0.1 mol·L-1NH3·H2O溶液中存在如下电离平衡:NH3·H2O NH
NH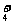 +OH-。下列叙述正确的是( )
+OH-。下列叙述正确的是( )
A.加入少 量浓盐酸,平衡逆向移动
量浓盐酸,平衡逆向移动
B.加入少量NaOH固体,平衡正向移动
C.加入少量0.1 mol·L-1NH4Cl溶液,溶液中c(OH-)减小
D.加入少量MgSO4固体,溶液pH增大
解析:本题主要考查电离平衡的影响因素,对于平衡体系NH3·H2O NH
NH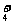 +OH-加入少量浓盐酸,发生H++OH-===H2O使OH-浓度降低,平衡正向移动;加入少量NaOH固体,使OH-浓度升高,平衡逆向移动;加入少量0.1 mol·L-1 NH4Cl溶液,使NH
浓度升高,平衡逆向移动,溶液中c(OH-)减小;加入少量MgSO4固体,发生Mg2++2OH-===Mg(OH)2↓,溶液中c(OH-)减小。
+OH-加入少量浓盐酸,发生H++OH-===H2O使OH-浓度降低,平衡正向移动;加入少量NaOH固体,使OH-浓度升高,平衡逆向移动;加入少量0.1 mol·L-1 NH4Cl溶液,使NH
浓度升高,平衡逆向移动,溶液中c(OH-)减小;加入少量MgSO4固体,发生Mg2++2OH-===Mg(OH)2↓,溶液中c(OH-)减小。
答案:C
2.下列实验事实不能证明醋酸是弱酸的是( )
A.常温下,测得醋酸钠溶液的pH>7
B.常温下,测得0.1 mol·L-1醋酸溶液的pH=4
C.常温下,将pH=1的醋酸溶液稀释1 000倍,测得pH<4
D.常温下,将物质的量浓度相同的醋酸溶液与氢氧化钠溶液等体积混合后恰好中和
解析:证明是弱电解质可以从电离和所对应的盐溶液是否水解两种观点解题。A项是所对应的溶液发生水解,可以;B项是不完全电离。可以;C项是加水促进醋酸的电离,可以;D项只能证明醋酸是一元酸,不能证明其是弱酸。
答案:D
1.常温下向20 mL 0.1 mol·L-1的NaOH溶液中加入V mL 0.1 mol·L-1的一元酸HA,下列结论正确的是 ( )
A.若c(Na+)=c(A-)>c(H+)=c(OH-),则V一定等于20 mL
B.当V<20 mL时,一定有c(Na+)>c(A-)>c(OH-)>c(H+)
C.溶液呈中性时,V≥20 mL
D.当V>20 mL时,一定有c(A-)>c(Na+)>c(H+)>c(OH-)
解析:HA酸性不确定,当HA是弱酸时,若使溶液呈中性,所需HA体积要大于20mL。当HA是强酸时,所需HA体积等于20 mL,故A错,C正确。当V很小时,有可能c(A-)<c(OH-)。故B错。当V很大时,有可能c(Na+)<c(H+),故D错。
答案:C
3、电离平衡(如盐的水解原理在工农业生产、日常生活中的广泛应用等)是高考的必考内容。电离平衡类试题在高考卷中出现的知识点有下列内容:强弱电解质的电离、pH与起始浓度的关系、有关混合溶液 pH的计算、改变条件对弱电解质电离平衡离子浓度的影响、离子浓度的大小比较、中和滴定指示剂的选择、盐类水解、物料守恒、电荷守恒等。
pH的计算、改变条件对弱电解质电离平衡离子浓度的影响、离子浓度的大小比较、中和滴定指示剂的选择、盐类水解、物料守恒、电荷守恒等。
测试题
2.溶液pH的计算与生物酸碱平衡相结合或运用数学工具(图表)进行推理等试题在高考中出现的可能性较大。
1.外界条件对弱电解质和水电离平衡的影响及强、弱电解质的比较仍将是命题的重点。
9.工农业生产中化肥使用时,也要考虑某些化肥不能混合使用,如K2CO3与NH4Cl不能混施等。
例1、(2009安徽)向体积为0.05mol·L-1CH3COOH溶液中加入体积为Vb的0.05mol·L-1KOH溶液,下列关系错误的是
A. Va>Vb时:c (CH3COOH) +c (CH3COO-)>c (K+)
B. Va=Vb时:c (CH3COOH) +c (H+)>c (OH-)
C. Va<Vb时:c (CH3COO-)>c (K+)> c (OH-)> c (H)
D. Va与Vb任意比时:c (K+)+ c (H+) =c (OH-)+ c (CH3COO-)
 例2、(2009上海)
例2、(2009上海) 根据以下事实得出的判断一定正确的是
根据以下事实得出的判断一定正确的是
 A.HA的酸性比HB的强,则HA溶液pH比HB溶液的小
A.HA的酸性比HB的强,则HA溶液pH比HB溶液的小
 B.
B.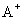 和
和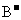 的电子层结构相同,则A原子的核电荷数比B原子的大
的电子层结构相同,则A原子的核电荷数比B原子的大
 C.A盐的溶解度在同温下比B盐的大,则A盐溶液的溶质质量分数比B盐溶液的大
C.A盐的溶解度在同温下比B盐的大,则A盐溶液的溶质质量分数比B盐溶液的大
 D.A原子失去的电子比B原子的多,则A单质的还原性比B单质的强
D.A原子失去的电子比B原子的多,则A单质的还原性比B单质的强
[答案]B
[解析]A、酸性的强弱不能说明对应PH的大小,故A错。B、A+和B-的电子层结构相同则在B的下一个周期, A原子的核电荷数比B原子的大,故B对。C、溶液的溶质的质量分数和溶解度的大小不存在绝对的关系,本项中缺少饱和二字更加没有绝对关系,故C错。D、原子失去电子的多少,与单质还原性的强弱没有关系,如Mg和Al。故D错。
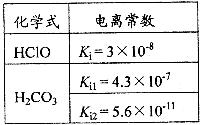
例3、(2009上海) 根据右表提供的数据,判断在等浓度的
根据右表提供的数据,判断在等浓度的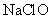 、
、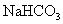 混
混
合溶液中,各种离子浓度关系正确的是
 A.
A.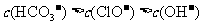
 B.
B.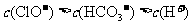
 C.
C.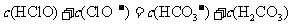
 D.
D.
 例4、(2009上海
例4、(2009上海 )对于常温下pH为1的硝酸溶液,下列叙述正确的是
)对于常温下pH为1的硝酸溶液,下列叙述正确的是
 A.该溶液lmL稀释至100mL后,pH等于3
A.该溶液lmL稀释至100mL后,pH等于3
 B.向该溶液中加入等体积、pH为13的氢氧化钡溶液恰好完全中和
B.向该溶液中加入等体积、pH为13的氢氧化钡溶液恰好完全中和
 C.该溶液中硝酸电离出的
C.该溶液中硝酸电离出的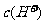 与水电离出的
与水电离出的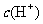 之比值为
之比值为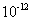 。
。
 D.该溶液中水电离出的
D.该溶液中水电离出的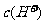 是pH为3的硝酸中水电离出的
是pH为3的硝酸中水电离出的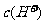 的100倍
的100倍
[答案]AB
[解析]A、硝酸为强酸,稀释100倍PH上升2,故A对。B、氢氧化钡为强碱,二者等体积PH之和为14混合恰好中和,故B对。C、溶液中由硝酸电离出的H+浓度为10-1mol/L,而由水电离出的H+浓度为10-13 mol/L,二者比值为1012,故C错。D、该溶液中水电离出的H+浓度为10-13 mol/L,而pH为3的硝酸中水电离出的H+浓度为10-11 mol/L,前者是后者的1/100.
例5、(2009广东理基) 下列说法正确的是( )
下列说法正确的是( )
 A.向0.1 mol/L Na2CO3溶液中滴加酚酞,溶液变红
A.向0.1 mol/L Na2CO3溶液中滴加酚酞,溶液变红
 B.Al3+、NO3- 、Cl-、CO32 -、Na+可大量共存于pH=2的溶液中
B.Al3+、NO3- 、Cl-、CO32 -、Na+可大量共存于pH=2的溶液中
 C.乙醇和乙酸都能溶于水,都是电解质
C.乙醇和乙酸都能溶于水,都是电解质
 D.分别与等物质的量的HCl和H2SO4反应时,消耗NaOH的物质的量相同
D.分别与等物质的量的HCl和H2SO4反应时,消耗NaOH的物质的量相同
 [答案]A
[答案]A
 [解析]Na2CO3溶液水解显碱性,加入酚酞是变红的,A正确;pH=2为酸性溶液,所以CO32 -与H+是反应的,不能共存,B项错错误;乙醇属于非电解质,C错误;硫酸为二元强酸,所以NaOH的物质的量是HCl的两倍,D错误。
[解析]Na2CO3溶液水解显碱性,加入酚酞是变红的,A正确;pH=2为酸性溶液,所以CO32 -与H+是反应的,不能共存,B项错错误;乙醇属于非电解质,C错误;硫酸为二元强酸,所以NaOH的物质的量是HCl的两倍,D错误。
例6、(2009全国1)用0.10 mol·L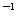 的盐酸滴定0.10 mol·L
的盐酸滴定0.10 mol·L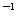 的氨水,滴定过程中不可能出现的结果是
的氨水,滴定过程中不可能出现的结果是
A.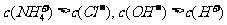
B.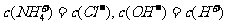

C.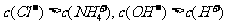
D. 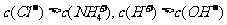

[答案]C
[解析]溶液中阴离子电荷总数大于阳离子电荷总数,不遵循电荷守恒,故C项错。
例7、(2009全国2)下列关于溶液和胶体的叙述,正确的是
A.溶液是电中性的,胶体是带电的
B.通电时,溶液中的溶质粒子分别向两极移动,胶体中的分散质粒子向某一极移动
C.溶液中溶质分子的运动有规律,胶体中分散质粒子的运动无规律,即布朗运动
D.一束光线分别通过溶液和胶体时,后者会出现明显的光带,前者则没有
[答案]D
[解析]胶体本身是不带电,只是其表面积较大,吸附了溶液中的离子而带了电荷, A错误;溶液中的溶质,要看能否电离,若是非电解质,则不导电,也不会移动,B错误;布朗运动本身即是无规律的运动,C错误;丁达尔效应可以用来区分溶液和胶体,D正确。
例8、(2009全国2)现有等浓度的下列溶液:①醋酸、②苯酚、③苯酚钠、④碳酸、⑤碳酸钠、⑥碳酸氢钠。按溶液pH由小到大排列正确的是
A.④①②⑤⑥③ B.④①②⑥⑤③
C.①④②⑥③⑤ D.①④②③⑥⑤
[答案]C
[解析]①④均属于酸,其中醋酸最强,碳酸次之,②苯酚显弱酸性;③⑤⑥均属于强碱弱酸盐,显碱性。根据越弱越水解的原理知,因H2CO3>苯酚>HCO3- ,所以对应盐的碱性为:碳酸钠 >苯酚钠>碳酸氢钠,C正确。
>苯酚钠>碳酸氢钠,C正确。
[2010高考预测]
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com