
16.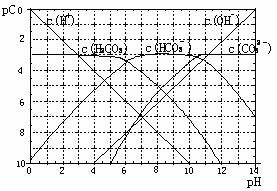 pC类似pH,是指极稀溶液中溶质物质的量浓度的常用对数负值。如某溶液溶质的浓度为:1×10-3mol/L,则该溶液中该溶质的pC=-lg1×10-3=3。已知H2CO3溶液中存在的化学平衡为CO2+H2O
pC类似pH,是指极稀溶液中溶质物质的量浓度的常用对数负值。如某溶液溶质的浓度为:1×10-3mol/L,则该溶液中该溶质的pC=-lg1×10-3=3。已知H2CO3溶液中存在的化学平衡为CO2+H2O H2CO3
H2CO3 H++HCO3
H++HCO3 2H++CO32-。右图为H2CO3溶液的pC-pH图。
2H++CO32-。右图为H2CO3溶液的pC-pH图。
请回答下列问题:
(1)在pH=12时,H2CO3溶液中主要存在的含碳阴离子为: ;
(2)pH<5时,溶液中H2CO3的pC值总是约等于3的原因是 ;
(3)一定浓度的NaHCO3和Na2CO3混合溶液是一种“缓冲溶液”,在这种溶液中加入少量的强酸或强碱,溶液的pH变化不大,其原因是 。
解析:pH=12做一条垂直与pH轴与含碳阴离子CO32-、HCO3-曲线各有一个交点,H2CO3溶液中主要存在的含碳阴离子为CO32-、HCO3-;pH<5时,溶液中H2CO3的pC值总是约等于3的原因CO2本身在水中的溶解度小和H+浓度增加,以下平衡CO2+H2O H2CO3
H2CO3 H++HCO3
H++HCO3 2H++CO32-左移动,放出CO2。
2H++CO32-左移动,放出CO2。
一定要把握缓冲溶液的含义,在该溶液中加入少量的酸,H+与CO32-结合生成HCO3-(或使平衡:HCO3-  H++C
H++C O32-向左移动,结果溶液中H+浓度增加得很少;若在溶液中加入少量的碱,OH-与HCO3-结合生成CO32-(或使平衡HCO3-
O32-向左移动,结果溶液中H+浓度增加得很少;若在溶液中加入少量的碱,OH-与HCO3-结合生成CO32-(或使平衡HCO3- H++CO32-向右移动),结果溶液中的OH-浓度也增加不大。
H++CO32-向右移动),结果溶液中的OH-浓度也增加不大。

15.现有电解质溶液:①Na2CO3、②NaHCO3、③NaAlO2、④CH3COONa 、⑤NaOH,且已知:CO
、⑤NaOH,且已知:CO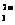 +3H
+3H 2O+2AlO
2O+2AlO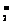 ===2A1(OH)3↓+CO2↑。
===2A1(OH)3↓+CO2↑。
(1)当五种溶液的pH相同时,其物质的量浓度由大到小的顺序是 (填编号)。
(2)将上述物质的量浓度均为0.1 mol·L-1的五种溶液,稀释相同倍数时,pH变化最大的是 (填编号)。
(3)在上述五种电解质溶液中,分别加入AlCl3溶液,无气体产生的是
(填编号)。
(4)将上述①②③④四种电解质溶液混合,发生反应的离子方程式为 。
解析:根据所给方程式可知Al(OH)3酸性比H2CO3弱。由于盐溶液的碱性强弱取决于阴离子的水解能力,故当pH相同时,越难水解的盐,浓度越大;前四种都是能水解的盐溶液,其中都存在着水解平衡,当稀释时,由于平衡的移动,溶液的酸碱性变化会得以缓冲,变化的幅度会减少,而NaOH溶液中的n(OH-)基本不变,在体积增大时c(OH-)的变化幅度会是最大的。其pH变化也最大;①和②由于盐水解的相互促进,都与Al3+作用产生CO2气体,后三种溶液没有提供产生气体的离子,所以都不会有气体产生;四种溶液混合能否发生离子反应,主要看阴离子间能否相互作用,依据信息,只有AlO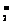 和HCO
和HCO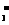 可以反应。
可以反应。
答案:(1)④>②>①>③>⑤ (2)⑤ (3)③④⑤ (4)AlO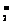 +HCO
+HCO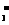 +H2O===Al(OH)3↓+CO
+H2O===Al(OH)3↓+CO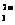
14.某溶液中存在的离子有:S2、HS-、OH-、Na+、H+,则下列有关对该溶液的叙述中不正确的是( )
A.离子浓度可能是c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+)
B.组成该溶液的溶质只能是Na2S或NaHS或两者的混合物
C.该溶液可能呈中性 ,或碱性,或酸性
,或碱性,或酸性
D.离子物质的量的关系是2n(S2-)+n(HS-)+n(OH-)=n(Na+)+n(H+)
解析:Na2S溶液中存在A项关系式;Na2S、H2S的混合溶液中也存在题干中的离子,故B项错误,C项正确;D项,符合电荷守恒。
答案:B
13.将20mL0.4mol/L硝酸铵溶液跟50mL0.1mol/L氢氧化钡溶液混合,则混合溶液中粒子浓度间的关系正确的是
A.c(NO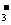 )>c(OH-)>c(NH
)>c(OH-)>c(NH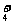 )>c(Ba2+)
)>c(Ba2+)
B.c(NO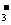 )>c(Ba2+)>c(NH
)>c(Ba2+)>c(NH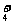 )>c(OH-)
)>c(OH-)
C.c(NO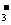 )=c(NH
)=c(NH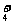 )+c(NH3·H2O)+c(NH3)
)+c(NH3·H2O)+c(NH3)
D.2c(Ba2+)+c(H+)=c(NO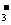 )+c(OH-)
)+c(OH-)
解析:由数据可知,碱过量,n(NO3-)=0.008mol,n(Ba2+)=0.005mol,剩余n(OH-)=0.002mol,A选项错误;NH4+已经反应完全,B选项错误;根据NO3-和NH4+的守恒,可知C选项正确;选项中氨水会部分电离NH4+,D选项错误。
答案:C
12. 将0.2 mol·L-1 NaA溶液和0.1
mol·L-1盐酸等体积混合后,溶液pH<7,则以下关系式错误的是( )
将0.2 mol·L-1 NaA溶液和0.1
mol·L-1盐酸等体积混合后,溶液pH<7,则以下关系式错误的是( )
A.c(HA)+c(A-)=0.1 mol·L-1 B.c(A-)>c(HA)
C.c(Na+)+c(H+)=c(A-)+c(Cl-)+c(OH-) D.c(Na+)=c(A-)=c(HA)
解析:尽管存在HA的电离和A-的水解,但二者的加和不变,故A项正确;溶液pH<7,说明电离大于水解,故B项正确,D项错误;C项体现了电荷守恒,正确。
答案:D
11.下列各溶液中,粒子的物质的量浓度关系正确的是( )
A.0.1 mol·L-1的CH3COONa溶液中:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
B.0.1 mol·L-1的Na2CO3溶液中:c(OH-)=c(HCO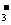 )+c(H+)+c(H2CO3)
)+c(H+)+c(H2CO3)
C.0.1 mol·L-1 的NH4Cl溶液中:C(Cl-)>C(NH
的NH4Cl溶液中:C(Cl-)>C(NH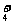 )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
D.c(NH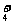 )相等的(NH4)2SO4溶液、NH4HSO4溶液、(NH4)2CO3溶液、NH4Cl溶液:c[(NH4)2SO4]< c[(NH4)2CO3]<c(NH4HSO4)<c(NH4Cl)
)相等的(NH4)2SO4溶液、NH4HSO4溶液、(NH4)2CO3溶液、NH4Cl溶液:c[(NH4)2SO4]< c[(NH4)2CO3]<c(NH4HSO4)<c(NH4Cl)
10. 下列溶液一定呈中性的是( )
下列溶液一定呈中性的是( )
A.将pH=5的盐酸稀释100倍所得到的溶液
B.等物质的量的强酸和强碱反应后所得到的混合溶液
C.c(H+)=c(OH-)=1×10-6 mol·L-1的 溶液
溶液
D.非电解质溶于水得到的溶液
解析:A项错误;B项酸、碱元数不定,故错误;C项正确;D项CO2的水溶液呈酸性,NH3的水溶液呈碱性,故错误。
答案:C
9.4体积的pH=9的Ca(OH)2溶液与1体积的pH=13的NaOH溶液混合后,溶液中氢离子浓度为 ( )
A.5×10-13 mol·L-1
B.2×10-12 mol·L-1
C.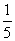 (1×10-1+4×10-5)mol·L-1
(1×10-1+4×10-5)mol·L-1
D.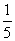 (1×10-13+4×10-9)mo
(1×10-13+4×10-9)mo l·L-1
l·L-1
8.把1 L 0.1 mol·L-1醋酸溶液用蒸馏水稀释到10 L,下列叙述正确的是( )
A.c(CH3COOH)变为原来的1/10
B.c(H+)变为原来的1/10
C.c(CH3COO-)/c(CH3COOH)的比值增大
D.溶液的导电性增强
解析:CH3COOH CH3COO-+H+,当加水稀释时,CH3COOH、CH3COO-、H+浓度均减小,但电离为可逆的,故A项、B项、D项错误,C项正确。
CH3COO-+H+,当加水稀释时,CH3COOH、CH3COO-、H+浓度均减小,但电离为可逆的,故A项、B项、D项错误,C项正确。
答案:C
7.等体积的pH=12的碱溶液甲和pH=11的碱溶液乙,分别用等浓度的盐酸中和时,消耗盐酸的体积为2V甲=V乙。下列判断合理的是 ( )
A.乙一定是弱碱
B.甲一定是强碱
C.乙一定是二元碱
D.甲一定是一元碱
解析:甲溶液的氢氧根浓度是乙溶液的10倍,如果都是强碱,分别用等浓度的盐酸中和时,消耗盐酸的体积为V甲=10V乙,但现在乙却消耗的盐酸较多,由此可见乙一定是弱电解质。
答案:A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com