
25.(7分)下表是不同温度下水的离子积数据:
|
温度/℃ |
25 |
t1 |
t2 |
|
水的离子积 |
1×10-14 |
a |
1×10-12 |
试回答以下问题:
(1)若25<t1<t2,则a 1×10-14 (填“>”、“<”或“=” ,作此判断的理由是 。
,作此判断的理由是 。
(2)t2 ℃下,将pH = 11的苛性钠溶液V1L与pH = 1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH = 2,则V1∶V2 = 。此溶液中各种离子的浓度由大到小的排列顺序是 。
(3)25℃时,重水(D2O)的离子积为1.6×10-15,也可用pH值一样的定义来规定其酸碱度:pD=-lg[D+],下列有关pD的叙述,正确的是 。(填编号)
①中性D2O的pD>7;
②在1LD2O中,溶解0.01molNaOD,其pD值为12;
③1L0.01mol/L的DCl的重水溶液,pD=2;
④在100mL 0.25mol/L DCl的重水溶液中,加入50mL 0.2mol/L NaOD的重水溶液,反应后溶液的pD=1。
24.(10分)已知A为常见金属,X、Y为常见非金属,X、E、F、G、I、J常温下为气体,C为液体。J是天然气的主要成分,B是一种盐,受热极易分解,在工农业生产中用途较广(如被用作某些电池的电解质)。现用A与石墨作电极,B的浓溶液作电解质,构成原电池。有关物质之间的转化关系如下图:(注意:其中有些反应的条件及部分生成物被略去)


请填写下列空白:
(1)从D溶液制备D的无水晶体的“操作a”为 。
(2)用A与B溶液组成的原电池电解D,正极的电极方程式为
。当生成氯气的体积为11.2L(标准状况)时,高铁电池消耗的负极材料的质量为 g。
(3)反应②的化学方程式为 。反应⑤的化学方程式为 。
(4)J与C或I经高温催化反应可制得合成气X和Z,合成气(X+Z)是一种重要的化工原料,在化工生产中具有十分广泛的用途。合成气除用于有机合成外,还可用于冶炼金属,其制备及运用的一种工艺流程如图所示:


①写出J与C反应制备合成气的化学方程式_______________________________。
②写出用合成气生产乙二醇的化学方程式_________________________,用该方法合成乙二醇的最大优点是___________________________________;在合成气冶炼金属铁的流程中,向燃烧室中通入J与氧气的目的是_____________________________。
③在上述炼铁过程的某时间段内,若有xm3(标准状况)的J进入燃烧室中充分燃烧,还原反应室有5ykg(即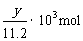 )铁生成,假设燃烧室与还原反应室产生的高温尾气全部进入催化反应室,则这些高温尾气在理论上可产生合成气
m3(标准状况)。
)铁生成,假设燃烧室与还原反应室产生的高温尾气全部进入催化反应室,则这些高温尾气在理论上可产生合成气
m3(标准状况)。
23.(10分)A、Z、R、D、E、F、G是七种原子序数依次增大且不大于20的元素,其中有两种非金属元素位于同一主族。已知A、Z、D均能与R形成原子(或离子)个数不同的几种常见化合物。请回答下列有关问题。
(1)X、Y是D、F形成的最高价氧化物对应的水化物,浓度均为0.1mol/L的X、Y溶液的pH之和为14。X、Y的晶体熔点相对高低为(写化学式) ,导致这种差异存在的原因是 。在相同温度下,相等物质的量的X、Y的溶液中,由水电离出的c(H+)的相对大小关系为 。
(2)A与Z、E均可形成正四面体构型的气态分子Q、P,由P、空气、KOH可构成燃料电池,其负极的反应式为 。
(3)上述七种元素间能形成多种常见二元化合物,其中Z与G形成的一种化合物存在两类化学键,该物质溶于稀HCl溶液的化学反应方程式为
。ZR2的电子式为 ,化合物ZRF2的结构式为 。
(4)R能形成多种单质,如R2、R3等。据报道,最近科学家制得了一种组成为R4的分子,每个R原子均与另外两个R原子各形成一个键,则1mol R4中共用电子对数为 NA,下列有关R4的说法正确的是 。(填编号)
①R4与R2、R3互为同位素 ②R4不能与A、Z、D的单质反应
③R4中各原子最外电子层均为8电子结构 ④R4固体属于分子晶体
21. 将4.6gNa和2.7gAl同时加入到足量的水中充分反应,将反应后的溶液稀释、定容为500mL。下列说法正确的是
A.反应中放出的气体在标准状况下的体积为2.24L
B.反应中消耗的水的质量是加入的Al的质量的2倍
C.所得溶液中Na+和Al3+的物质的量之比为2∶1
D.所得溶液中阳离子和阴离子的物质的量之比为2∶1
成都七中高2011级高中毕业班摸底测试化学试卷(二)
考试时间:100分钟 总分:100分
第Ⅱ卷 非选择题(共58分)
20. 据世界卫生组织调查,缺铁性贫血是世界上最流行的营养性问题,一个简单的办法即是在普通酱油中加入无铁腥味、极易被人体吸收的添加剂--EDTAFeNa,其中EDTA的结构如下左图所示,酱油生产以后的废水可用物质绿色消毒剂(消毒后无公害)X(如下右图)来杀菌。


下列说法正确的是
A.1mol EDTA能与4mol H2发生反应
B.可用分液漏斗从铁强化酱油中分离出EDTAFeNa
C.EDTA和X在一定条件下均能发生水解反应
D.X起氧化杀菌作用的可能是其水解产物次氯酸
19. 某烷烃的各种同分异构体中,主链上有4个碳原子的只有两种结构,则含有相同碳原子数且主链上也有4个碳原子的烯烃(只含一个碳碳双键)的同分异构体有
A.5种 B.4种 C.3种 D.2种
18. 右图表示的是一种金属醇盐的电化学合成装置。在电解过程中,已知乙醇和乙酰丙酮(CH3COCH2COCH3)在阴极发生的电极反应为2CH3CH2OH+2e-=2CH3CH2O-+H2↑、2CH3COCH2COCH3+2e-=2(CH3COCHCOCH3)-+ H2↑。下列说法中不正确的是
A.阳极Pb失去电子,发生氧化反应
B.当阳极失去2mol e-时,阴极产生2mol氢气
C.电解过程中,阳离子向阴极移动
D.已知Pb-4e-=Pb4+,当消耗Pb的质量为103.5g时,则转移电子2mol
17. 海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:


下列说法中不正确的是
A.步骤①灼烧海带时,需要用到的实验仪器是三角架、泥三角、坩埚、酒精灯
B.步骤③的实验操作名称是过滤,步骤⑥的实验操作名称是蒸馏
C.步骤⑤中使用CCl4、酒精等有机溶剂同样能够达到实验目的
 D.步骤④中可通过向提取碘后的水溶液中加入几滴淀粉试液来判断是否还含有单质碘
D.步骤④中可通过向提取碘后的水溶液中加入几滴淀粉试液来判断是否还含有单质碘
16. 右表为元素周期表短周期的一部分。下列有关A、B、C、D、E五种元素的叙述中,不正确的是
右表为元素周期表短周期的一部分。下列有关A、B、C、D、E五种元素的叙述中,不正确的是
A.A与B形成的阴离子可能有:AB32-、A2B42-
B.五种元素形成的气态氢化物中,C的氢化物最稳定
C.D的氢化物在过量的B中燃烧的主要产物为DB3
D.由这5种元素中的几种形成的只含极性键的非极性分子多于3种
15. 某溶液中只存在OH-、H+、NH4+、Cl-四种离子,且浓度大小的顺序为c(NH4+)>c(Cl-)>c(OH-)>c(H+),该溶液可能是
A.由0.01mol/L的NH3·H2O溶液与0.01mol/L的HCl溶液等体积混合而成
B.由0.01mol/L的NH4Cl溶液与0.01mol/L的HCl溶液等体积混合而成
C.由10mL pH=11的0.01mol/L的NH3·H2O溶液与1mL pH=3的HCl溶液等体积混合而成
D.由0.01mol/L的NH4Cl溶液与0.01mol/L的NH3·H2O溶液等体积混合而成
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com