
1.C8H8,10mol
30.(16分)
固定和利用CO2能有效地利用资源,并减少空气中的温室气体.CO2与化合物Ⅰ反应生成化合物Ⅱ,与化合物Ⅲ反应生成化合物Ⅳ,如反应①和②所示(其他试剂、产物及反应条件均省略).
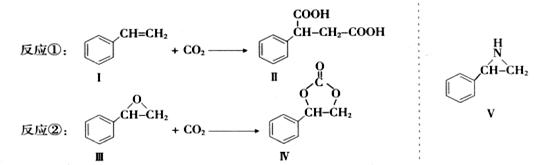
(1)化合物Ⅰ的分子式为______,1 mol该物质完全燃烧需消耗_______mol O2 .
(2)由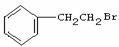 通过消去反应制备Ⅰ的化学方程式为________(注明反应条件).。
通过消去反应制备Ⅰ的化学方程式为________(注明反应条件).。
(3)Ⅱ与过量C2H5OH在酸催化下发生酯化反应,生成的有机物的结构简式为________.
(4)在一定条件下,化合物V能与CO2发生类似反应②的反应,生成两种化合物(互为同分异构体),请写出其中任意一种化合物的结构简式:________.
(5)与CO2类似,CO也能被固定和利用.在一定条件下,CO、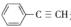 和H2三者发生反应(苯环不参与反应),生成化合物Ⅵ和Ⅶ,其分子式均为C9H8O,且都能发生银镜反应.下列关于Ⅵ和Ⅶ的说法正确的有________(双选,填字母).
和H2三者发生反应(苯环不参与反应),生成化合物Ⅵ和Ⅶ,其分子式均为C9H8O,且都能发生银镜反应.下列关于Ⅵ和Ⅶ的说法正确的有________(双选,填字母).
A.都属于芳香烃衍生物 B.都能使溴的四氯化碳溶液褪色
C.都能与Na反应放出H2 D. 1 molⅥ或Ⅶ最多能与4 mol H2发生加成反应
23.铜锌原电池(如图9)工作时,下列叙述正确的是
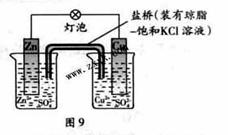 A 正极反应为:Zn-2e-=Zn2+
A 正极反应为:Zn-2e-=Zn2+
B。电池反应为:Zn+Cu2+=Zn2+ +Cu
C 在外电路中,电子从负极流向正极
D 盐桥中的K+移向ZnSO4溶液
A答案应为负极。D答案盐桥中的K+移向CuSO4溶液
22.对实验Ⅰ~Ⅳ的实验现象预测正确的是
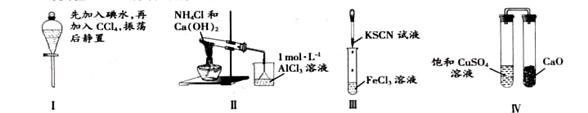
A 实验Ⅰ:液体分层,下层呈无色
B 实验Ⅱ:烧杯中先出现白色沉淀,后溶解
C.实验Ⅲ:试管中溶液颜色变为红色
D 实验Ⅳ:放置一段时间后,饱和CuSO4溶液中出现蓝色晶体
A答案CCl4密度比水大,在下层,上层为水层呈无色。B答案沉淀不会溶解。C答案Fe3+与KSCN结合为血红色。D答案因为CaO有吸水性。
12. HA为酸性略强与醋酸的一元弱酸.在0.1mol.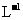 NaA溶液中,离子浓度关系正确的是
NaA溶液中,离子浓度关系正确的是
A. c(Na+)> c(A-)> c(H+)> c(OH-)
B. c(Na+)>c(OH-) > c(A-) > c(H+)
C. c(Na+)+ c(OH-)= c(A- )+ c(H+)
D. c(Na+)+ c(H+)= c(A-)+ c(OH-)
NaA属于强碱弱酸盐,水溶液显碱性,根据电荷守恒可知D答案正确
11.下列说法正确的是
A.乙烯和乙烷都能发生加聚反应
B.蛋白质水解的最终产物是多肽
C.米酒变酸的过程涉及了氧化反应
D.石油裂解和油脂皂化都有高分子生成小分子的过程
A答案乙烷不能发生加聚反应。B答案蛋白质水解的最终产物是氨基酸。C答案米酒部分氧化为乙酸。D答案裂解指把长链的分子烃断裂成各种短链的气态烃和少量液态烃。油脂皂化是指油脂在碱性条件下发生水解,不属于高分子。
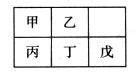
10.短周期金属元素甲~戊在元素周期表中的相对位置如右表所示:
下面判断正确的是
A.原子半径: 丙<丁<戊 B金属性:甲>丙
C.氢氧化物碱性:丙>丁>戊 D.最外层电子数:甲>乙
A答案应该为丙>丁>戊。B答案应该为甲<丙。C答案因为金属性丙>丁>戊,故正确。D答案应该为甲<乙。
9.在298K、100kPa时,已知:2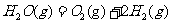 ⊿
⊿
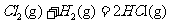 ⊿
⊿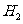

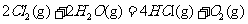 ⊿
⊿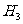
则⊿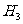 与⊿
与⊿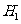 和⊿
和⊿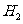 间的关系正确的是
间的关系正确的是
A
.⊿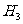 =⊿
=⊿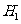 +2⊿
+2⊿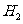 B ⊿
B ⊿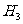 =⊿
=⊿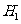 +⊿
+⊿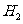
C. ⊿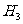 =⊿
=⊿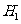 -2⊿
-2⊿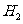 D. ⊿
D. ⊿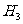 =⊿
=⊿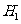 - ⊿
- ⊿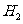
 根据盖斯定律可知为A
根据盖斯定律可知为A
8.设 nA 为阿伏加德罗常数的数值,下列说法正确的是
A.16g CH4中含有4 nA个C-H键
B.1mol.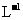
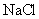 溶液含有nA个
溶液含有nA个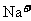
C.1mol Cu和足量稀硝酸反应产生nA个NO分子
D.常温常压下,22.4L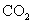 中含有nA个
中含有nA个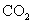 分子
分子
A.16gCH4为1mol,根据甲烷的结构式可知含有4 nA个C-H键。B.体积未知。C 根据电子守恒可知产生2nA/3个NO分子。D条件应该为标准状况。
7.能在溶液中大量共存的一组离子是
A . NH4+ 、Ag+ 、PO43- 、Cl- B. Fe3+、H+、I-、HCO3-
C.K+、 Na+、 NO3- 、 MnO4- D.Al3+ 、Mg2+ 、SO42- 、CO32-
A答案Ag+和PO43-、Cl-不能大量共存。B答案Fe3+和I-、HCO3-不能大量共存;H+和HCO3-也不能大量共存;D答案Al3+、Mg2+和CO32-不能大量共存
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com