
26.(8分)煤化工中常需研究不同温度下平衡常数、投料比及热值等问题
已知:CO(g)+H2O(g)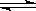 H2(g)+CO2(g)的平衡常数随温度的变化如下表:
H2(g)+CO2(g)的平衡常数随温度的变化如下表:
|
温度/℃ |
400 |
500 |
800 |
|
平衡常数Kc |
9.94 |
9 |
1 |
试回答下列问题
(1)上述正向反应是: 反应(选填:放热、吸热)。
(2)在800℃发生上述反应,以表中的物质的量投入恒容反应器,其中向正反应方向移动的有
(选填A、B、C、D、E)
|
|
A |
B |
C |
D |
E |
|
n(CO2) |
3 |
1 |
0 |
1 |
1 |
n(H2)
 |
2 |
1 |
0 |
1 |
2 |
|
n(CO) |
1 |
2 |
3 |
0.5 |
3 |
|
n(H2O) |
5 |
2 |
3 |
2 |
1 |
(3)已知在一定温度下:C(s)+CO2(g) 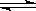 2CO(g)平衡常数K;
2CO(g)平衡常数K;
C(s) + H2O(g)
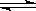 CO(g)+H2(g) 平衡常数K1;
CO(g)+H2(g) 平衡常数K1;
CO(g)+H2O(g)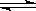 H2(g)+CO2(g)
平衡常数K2 ,
H2(g)+CO2(g)
平衡常数K2 ,
则K、K1、K2之间的关系是:

(4)在VL密闭容器中通入10molCO和10mol水蒸气,在T℃达到平衡,然后急速除去水蒸气(除水蒸气时各物质的物质的量不变),将混合气体燃烧,测得放出的热量为2842kJ(已知CO燃烧热为283kJ/mol,H2燃烧热为286kJ/mol),则T℃平衡常数K= 。
24.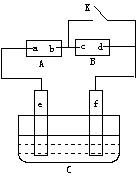 (10分)如图A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,请填空:
(10分)如图A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,请填空:
(1)电源A上的a为______________极
(2)滤纸B上发生的总化学方程式为:
(3)欲在电镀槽中实现铁上镀锌,接通K点,使c、d两点短路,则电极e上发生的反应为:_________________________ ,电极f上发生的反应为:_____________________,槽中盛放的镀液可以是____________溶液。
25(8分)将洁净的铁片和其他金属片A、B、C、D分别放在浸有NaCl溶液的滤纸上并压紧(如图3所示)。在每次实验时,记录电压表指针的移动方向和电压表的读数如下:
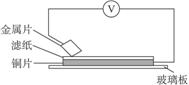
图3
|
|
金属 |
指针移动方向 |
电压 |
|
① |
Fe |
(-) |
0.65 |
|
② |
A |
(-) |
0.78 |
|
③ |
B |
(+) |
0.25 |
|
④ |
C |
(-) |
1.35 |
|
⑤ |
D |
(-) |
0.20 |
请回答下列问题:
(1)在第①组组成的原电池中,一段时间后,铁片上出现了红褐色物质。请用电极反应方程式和化学反应方程式表示其产生红褐色物质的过程
(2) A、B、C、D四种金属的金属性强弱顺序____________________________________,_________金属一定不能从硫酸铜溶液中置换出铜。
(3)若滤纸改用NaOH溶液浸润,则在滤纸上能看到有蓝色物质析出的是_________(填字母)金属。其对应的原电池的电极反应式为:
负极:_______________________________正极:______________________________
23.(共6分)
 (1)已知1g碳粉在氧气中完全燃烧放出的热量是32.8 kJ,试写出相关的热化学方程:
。
(1)已知1g碳粉在氧气中完全燃烧放出的热量是32.8 kJ,试写出相关的热化学方程:
。
(2)运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
①合成氨反应N2(g)+3H2(g) 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡
移动(填“向左”、“向右”或“不”);使用催化剂
反应的△H(填“增大”、“减小”或“不改变”)。
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡
移动(填“向左”、“向右”或“不”);使用催化剂
反应的△H(填“增大”、“减小”或“不改变”)。
②已知:O2(g)  O2+(g)+e-
△H1=+1175.7
kJ·mol-1
O2+(g)+e-
△H1=+1175.7
kJ·mol-1
PtF6(g)+e- PtF6-(g)
△H2=-771.1 kJ·mol-1
PtF6-(g)
△H2=-771.1 kJ·mol-1
O2PtF6(s) O2+(g)+PtF6-(g) △H3=+482.2 kJ·mol-1
O2+(g)+PtF6-(g) △H3=+482.2 kJ·mol-1
则反应O2(g)+PtF6(g)
 O2PtF6
(s)的 △H=_____________ kJ·mol-1
O2PtF6
(s)的 △H=_____________ kJ·mol-1
22.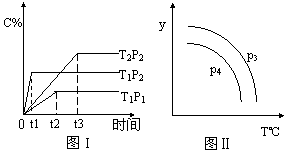 在某容积一定的密闭容器中,有下列的可逆反应:A(g) + B(g)
在某容积一定的密闭容器中,有下列的可逆反应:A(g) + B(g)  xC(g),有图I(T表示温度,P表示压强,C%表示C的体积分数)所示的反应曲线,试判断对图II的说法中正确的是( )
xC(g),有图I(T表示温度,P表示压强,C%表示C的体积分数)所示的反应曲线,试判断对图II的说法中正确的是( )
A.P3>P4,y轴表示B的百分含量
B.P3<P4,y轴表示B的体积分数
C.P3<P4,y轴表示混合气体的密度
D.P3>P4,y轴表示混合气体的平均摩尔质量
21. 在等温、等容条件下,有下列气体反应
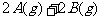

 。
。
现分别从两条途径建立平衡:
I. A、B的起始浓度均为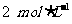
II. C、D的起始浓度分别为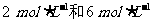
下列叙述正确的是
A. I、II两途径最终达到平衡时,体系内混合气的百分组成相同
B. I、II两途径最终达到平衡时,体系内混合气体的百分组成不同
C. 达到平衡时I途径的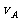 等于II途径的
等于II途径的
D. 达到平衡后,第I途径混合气密度为第二途径混合气密度相等
20.一个真空密闭容器中盛有1molPCl5,加热到200℃时发生了反应:PCl5(g) PCl3(g)+Cl2(g),反应达到平衡时PCl5的分解率为M%,若在同一温度和同样容器中最初投入的是2molPCl5,反应达
PCl3(g)+Cl2(g),反应达到平衡时PCl5的分解率为M%,若在同一温度和同样容器中最初投入的是2molPCl5,反应达 到平衡时PCl5的分解率为N%。M与N的关系是
到平衡时PCl5的分解率为N%。M与N的关系是
A.M>N B.M=N C.M<N D.无法确定
19.在一定温度不同压强(p1<p2)下,可逆反应2X(g)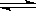 2Y(g)+Z(g)中,生成物Z在反应混合物中的体积分数(
2Y(g)+Z(g)中,生成物Z在反应混合物中的体积分数(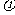 )与反应时间(t)的关系有以下图示,正确的是
)与反应时间(t)的关系有以下图示,正确的是
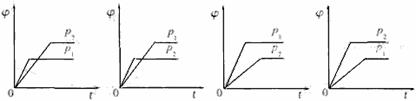
A B C D
18.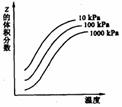 右图是温度和
右图是温度和 压强对X+Y
压强对X+Y 2Z反应影响的示意图。图中横坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是
2Z反应影响的示意图。图中横坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是
A. X和Y中只有一种为气态,Z为气态
B. X、Y、Z均为气态
C. 上述可逆反应的正反应为放热反应
D. 上述反应的逆反应的ΔH>0
17.图中C%表示某反应物在体系中的百分含量,v表示反应速度,P表示压强,t表示反应时间。图(A)为温度一定时压强与反应速度的关系曲线;图(B)为压强一定时,在不同时间C%与温度的关系曲线。同时符合以下两个图像的反应是
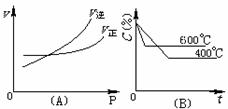 A.N2O3(g)
A.N2O3(g)  NO2(g)+NO(g) (△H>0)
NO2(g)+NO(g) (△H>0)
B.4NH3(g)+5O2(g)  4NO(g)+6H2O(g) (△H<0)
4NO(g)+6H2O(g) (△H<0)
C.3NO2(g)+H2O(l) 2HNO3(l)+NO(g) (△H<0)
2HNO3(l)+NO(g) (△H<0)
D.CO2(g)+C(s)  2CO(g)
(△H>0)
2CO(g)
(△H>0)
16.在一定温度下将1molCO和1molH2O(g)通入一个密闭容器中反应:
CO(g)+H2O(g)
 CO2(g)+H2(g),达到平衡后CO2的物质的量为0.6mol,再通入4molH2O(g)达到平衡后CO2的物质的量可能是
CO2(g)+H2(g),达到平衡后CO2的物质的量为0.6mol,再通入4molH2O(g)达到平衡后CO2的物质的量可能是

A.等于0.6mol B.等于1mol C.大于1mol D.大于0.6mol,小于1mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com