
25、(12分)
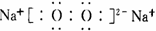

 ⑴碳(2分) (2分)
(2分)
⑴碳(2分) (2分)
(2分)  S (2分)
S (2分)
 ⑵
(2分)
⑵
(2分)
⑶ (2分)
24、(8分)按要求完成下列空白:
 ⑴Te (1分) ⑵5.6 (1分) ⑶Cu 1 (各1分) ⑷H2SeO4 (1分)
⑴Te (1分) ⑵5.6 (1分) ⑶Cu 1 (各1分) ⑷H2SeO4 (1分)
⑸ (1分) ⑹2F2 + 2H2O = 4HF + O2 (1分)
23、(9分)按要求回答下列问题:
⑴门捷列夫 (1分) ⑵18 (1分) ⑶六 (1分)
⑷第六周期、ⅡA族(1分) ⑸ⅢB族(1分) ⑹原子序数(1分)
⑺Na+ (1分) Na+和Cl 属于同周期的阴阳离子,而同周期阴离子半径大于阳离子半径(2分)
属于同周期的阴阳离子,而同周期阴离子半径大于阳离子半径(2分)
28、(7分)将14.4g铁粉与硫粉的混合物隔绝空气加热,使其充分反应,冷却,将所得的固体物质投入到足量的稀硫酸中,得到标准状况下的气体4.48L。试通过计算确定:
⑴原混合物中铁粉和硫粉各多少?
⑵所产生的气体的质量是多少?
七校联考半期试题化学答案及评分标准
27、(14分)某课外学习小组的同学设计了如下所示的装置,以验证SO2的氧化性、还原性和漂白性。回答以下问题:

⑴写出A中反应的离子方程式:________________________________________;
⑵写出C中反应的化学方程式:________________________________________;
⑶D中的现象是_____________________________________________;
⑷E中的现象是_____________________________________________;
⑸B中反应的化学方程式_______________________________________;
⑹如果F中装有碱石灰,那么F的作用是__________________________________。
⑺根据实验要求,简述使用开关a和b顺序及理由________________________________
_________________________________________________________________________。
26、(6分)X、Y、Z和W代表原子序数依次增大的四种短周期元素,它们满足以下条件:
①元素周期表中,Z与Y相邻,Z与W也相邻;
②Y、Z和W三种元素的原子最外层电子数之和为17
⑴Y、Z和W三种元素是否位于同一周期_________(填“是”、“否”),其理由是_______
__________________________________________________________________________;
⑵Y元素的符号是_________;
⑶X、Y、Z和W可组成一化合物,其原子个数之比为8∶2∶4∶1,写出该化合物的化学式____________________
25、(12分)A、B、C、D四种短周期元素,其原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质间反应条件不同反应产物也不同,其中一种产物E为淡黄色固体;D的L层上电子数等于K、M两个电子层上电子数之和。
⑴A元素的名称是_________;B元素原子的电子式为__________;C元素原子结构示意图为____________;如果D元素原子核中质子数等于其中子数,则它的原子符号是________。
⑵化合物E的电子式为_______________。
⑶用电子式表示C、D两元素形成化合物的过程________________________________。
24、(8分)按要求完成下列空白:
⑴氧族元素包括O、S、Se、_______、Po五种元素;
⑵正常雨水的pH值约为________;
⑶灼热的铜丝能与硫反应生成Cu2S,在这个反应还原剂是_________,如果有1molCu完全反应,则转移的电子的物质的量为_________mol;
⑷硒的最高价氧化物对应的水化物的化学式为___________;
⑸写出硫氢化钠的电子式___________;
⑹今年3月22是第18个“世界水日”。水是重要的自然资源,它在化学中占有重要的地位。
下列有关水的反应:
①与金属钠反应;②与氯气反应;③与炭反应;④与氟气反应;⑤与二氧化硫反应
其中水作还原剂的反应的化学方程式是__________________________________________;
23、(9分)按要求回答下列问题:
⑴元素周期律的发现者是________________;
⑵我们所学的周期表中共有____________个纵列;
⑶元素种类数最多的周期是第___________周期;
⑷主族元素X原子有6个电子层,最外层有2个电子,则它在周期表中的位置是______________________;
⑸若第五周期ⅠA族的元素Y的原子序数为n,则原子序数为n + 2的元素所在的族是_____________;
⑹在元素周期表中各个符号都有它的意义如下图所示,请完成下面的空白

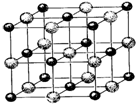 ⑺右图是氯化钠晶体中Na
⑺右图是氯化钠晶体中Na 和Cl
和Cl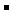 排列示意图,
排列示意图,
其中小黑球代表_____________(填Na+或Cl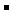 ),
),
请说明理由__________________________________________________________________。
22、常温常压下,将70L硫化氢和90L氧气混合,点燃使其充分反应,再恢复到原来条件,则生成的SO2气体的体积为:
A、70L B、60L C、55L D、35L
第 Ⅱ 卷(56分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com