
7.设NA为阿伏加德罗常数,下列有关叙述正确的是( )
A.28 g乙烯和28g丙烯中均含有6NA对共用电子对
B.在熔融状态下,l mol NaHSO4完全电离出的阳离子数目为2NA
6.著名化学家徐光宪,因为在稀土萃取领域取得了卓越成就而获得“国家最高科学技术奖”,被誉为“稀土界的袁隆平”。稀土元素是指镧系的15种元素,加上钪和钇共17种元素。下列说法正确的是 ( )
A.稀土元素全部是金属元素
B.要萃取出碘酒中的碘可以使用氢氧化钠溶液做萃取剂
 镧系元素均属于第七周期、第ⅢB族的元素
镧系元素均属于第七周期、第ⅢB族的元素
D.某些稀土元素在地壳中的含量高于铝
30.(16分)1 mol某烃的衍生物A在10 mol O2中恰好完全燃烧,产物只有CO2和k^s*5#uH2O,且其质量之比为11 :2。回答下列问题:
(1)A的分子式为____________________________。
(2)已知A的某种同分异构体A1可与NaHCO3产生气体,还可以使溴的CCl4溶液褪色,A1有如下的转化关系:

若A1和k^s*5#uA2互为同分异构体,A2分子中含有两个六元环,则A1的结构简式为_______。
(3)(2)中转化关系不涉及的反应类型是_____________(填序号)。
①加成反应 ②取代反应 ③氧化反应 ④酯化反应 ⑤消去反应
(4)B→C的反应方程式是______________________。
D→A2的反应方程式是______________________。
(5)写出同时符合下列两项要求的D的所有同分异构体的结构简式。
①化合物是1,3,5-三取代苯 ②化合物和k^s*5#uNaHCO3反应产生气体
(6)和k^s*5#uA具有相同碳原子数的某烷烃X,若其一氯代物只有两种,则X的名称为(用系统命名法命名)_____________。
29.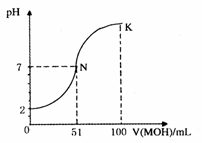 (14分)常温下,向100 mL0.01 mol·L-1HA溶液中逐滴加入0.02 mol·L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题:
(14分)常温下,向100 mL0.01 mol·L-1HA溶液中逐滴加入0.02 mol·L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题:
(1)由图中信息可知HA为__________酸(填“强”或“弱”),理由是_____________。
(2)常温下一定浓度的MA稀溶液的pH=a,则a_____7(填“>”、“<”或“=”),用离子方程式表示其原因为___________;此时,溶液中由水电离出的c(OH-)=_____________。
(3)请写出K点所对应的溶液中离子浓度的大小关系:_______________________。
(4)K点对应的溶液中,c(M+)+c(MOH)_____________2c(A-)(填“>”、“<”或“=”);若此时溶液中pH=10,则c(MOH)+c(OH-)=____________mol·L-1。
28.(15分)A、B、C、D、E为原子序数依次增大的五种短周期元素,其中C为短周期元素中(除稀有气体外)原子半径最大的元素,D和k^s*5#uA两元素原子的最外层电子数相同,B可以和k^s*5#u氢元素分别形成两核、三核、四核的10电子微粒。
I.根据以上信息回答下列问题:
(1)B、C结合成化合物的化学式可能为______________。
(2)工业上常用A的单质制取D的单质,其化学方程式为______________。
Ⅱ.工业上常用E元素和k^s*5#u另一种元素F形成的化合物X(相对分子质量为120)为原料,来制取强酸N,流程如下:

(1)F在周期表中的位置是_____________。
(2)工业上发生反应①、②、③的设备名称分别为_____________。
(3)已知反应①中有1 mol的X完全转化时放出热量为853 kJ,请写出该反应的热化学方程式___________________。
(4)X煅烧过程中,通入空气中N 2和k^s*5#uO 2的体积分数分别为0.80、0.20,请计算:
①标准状况下55 L空气和k^s*5#u足量X完全反应后,气体体积变为__________L;
②X被空气充分氧化后产生的混合气体中,设O 2的体积分数为α,则Y的体积分数为 (用含α的代数式表示)。
27.(15分)某化学课外小组利用H2还原R2O3粉末测定R元素的相对原子质量,下图是测量装置的示意图(加热和k^s*5#u夹持装置略去),A中的试剂是稀盐酸,B中固体是锌粒。

请回答下列问题:
(1)连接好装置后的实验操作依次是______________(填操作序号)
①检验氢气纯度 ②加热E ③检验装置气密性 ④点燃G管逸出的气体 ⑤从A瓶逐滴滴加液体
(2)C中的试剂是____________,其作用为_____________。
(3)从G管逸出的气体需要燃烧除去的原因是______________。
(4)在稀盐酸中加入少量CuSO4溶液,发现B中产生气体的速度明显加快,你认为原因是______________。
(5)该化学课外小组从实验中测得了下列数据:
①空E管的质量a;②E管和k^s*5#uR 2O 3的总质量b;③充分反应后E管和k^s*5#uR粉的总质量c(冷却到温室称量);④反应前F管及内盛物的总质量d;⑤充分反应后F管及内盛物的总质量e ;
根据以上数据列出二个计算R的相对原子质量的不同计算式(除R外,其它涉及的元素的相对原子质量均为已知):
计算式1:Ar(R)=__________________;
计算式2:Ar(R)=__________________。
13.标准状况下,将a L SO2和k^s*5#uCl2组成的混合气体通入100 mL 0.1 mol·L-1 Fe2(SO4)3溶液中,充分反应后,溶液的棕黄色变浅。向反应后的溶液中加入足量的BaCl2溶液,将所得沉淀过滤、洗涤、干燥后称重,其质量为11.65 g。则下列关于该过程的推断不正确的是
A.所得沉淀为0.05 mol BaSO4
 混合气体中SO2的体积为0.448 L
混合气体中SO2的体积为0.448 L
C.a L混合气体的物质的量为0.04 mol
D.a的取值范围为0.672 L<a<0.896 L
12.在一体积可变的密闭容器中,加入一定量的X、Y,发生反应mX(g) nY(g);△H=QkJ·mol-1。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下图所示:
nY(g);△H=QkJ·mol-1。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下图所示:

下列说法正确的是
A.m>n
 Q<0
Q<0
C.体积不变,温度升高,平衡向逆反应方向移动
D.温度不变,压强增大,Y的质量分数减少
11.在下图所示装置中,试管A、B中的电极为多孔的惰性电极;C、D为两个铂夹,夹在被Na2SO4溶液浸湿的滤纸条上,滤纸条的中部滴有KMnO4液滴;电源有a、b两极。若在A、B中充满KOH溶液后倒立于盛KOH溶液的水槽中,切断K1,闭合K2、K3,通直流电,实验现象如图所示。下列说法正确的是

A.电源中a为正极,b为负极
 试管A中的电极反应式为:2H++2e-=H2↑
试管A中的电极反应式为:2H++2e-=H2↑
C.一段时间后滤纸条上紫红色向C处移动
D.电解一段时间后,切断K2、K3,闭合K1,电流计的指针会发生偏转
10.a、b、c、d四种溶液,它们电离出的阳离子有Na+、Ag+、Al3+、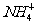 ,阴离子有Cl、
,阴离子有Cl、 、
、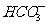 、OH。它们有如下反应现象:(1)a+b→白色沉淀;(2)a+c→白色沉淀+无色气体;(3)a+d→白色沉淀,d过量时沉淀无变化;(4)b+d→沉淀,d过量时沉淀溶解。关于这四种溶液说法中正确的是
、OH。它们有如下反应现象:(1)a+b→白色沉淀;(2)a+c→白色沉淀+无色气体;(3)a+d→白色沉淀,d过量时沉淀无变化;(4)b+d→沉淀,d过量时沉淀溶解。关于这四种溶液说法中正确的是
A.这四种溶液中所含溶质均为强电解质
 相同温度下水的电离程度:c>d
相同温度下水的电离程度:c>d
C.相同温度、相同浓度时溶液的pH:c>d
D.(1)、(2)、(3)中的沉淀可能是同一种物质
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com