
20.(10分)工业上可以利用氟硅酸、碳酸氢铵制备冰晶石(Na3AlF6),其工艺如下:
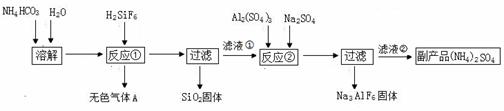 请回答:
请回答:
(1)反应①中生成的无色气体A是 ,滤液①的溶质是 。
(2)经测定NH4HCO3溶液呈中性,请分析原因(用两个离子方程式说明理由) , 。
(3)经反应②后,过滤得到的冰晶石(Na3AlF6)固体,该固体上附着有杂质,需要洗涤,请简述如何证明冰晶石固体已经洗涤干净 。
(4)温度和NH4HCO3浓度会影响反应①的速率。现设计如下实验方案探究温度和NH4HCO3浓度对反应①速率的影响。请在表格空白处填写适当的反应条件。
|
实验编号 |
实验目的 |
温度 |
c (NH4HCO3) |
|
Ⅰ |
为以下实验作参照 |
60℃ |
c 1 |
|
Ⅱ |
探究浓度对反应①速率的影响 |
|
c2 |
|
Ⅲ |
探究温度对反应①速率的影响 |
80℃ |
|
(5)下图是滤液①中溶质质量分数随温度变化的曲线图:
请分析t2℃时滤液①溶质质量分数下降的原因
。
19.(10分)用实验确定某酸HA是弱电解质。两同学的方案是:
甲:① 称取一定质量的HA配制0.lmol/L的溶液100mL;
② 用pH试纸测出该溶液的pH值,即可证明HA是弱电解质。
乙:① 用已知物质的量浓度的HA溶液、盐酸,分别配制pH=l的两种酸溶液各100mL;
② 分别取这两种溶液各10mL,加水稀释为100mL;
③ 各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质。
(1)在两个方案的第①步中,都要用到的定量仪器是
(2)甲方案中,说明HA是弱电解质的理由是测得溶液的pH 1(选填>、<、=)
乙方案中,说明HA是弱电解质的现象是 (多选扣分)
(a)装HCl溶液的试管中放出H2的速率快;
(b)装HA溶液的试管中放出H2的速率快;
(c)两个试管中产生气体速率一样快。
(3)请你评价:乙方案中难以实现之处和不妥之处
(4)请你再提出一个合理而比较容易进行的方案(药品可任取),作简明扼要表述。
。
18.(13分,计算2分,其余1分)Ⅰ。实验室为测定一新配制的稀盐酸的准确浓度,通常是用纯净的Na2CO3(无水)配成标准溶液滴定。具体操作是:称取wg纯净的无水Na2CO3装入锥形瓶中,加适量蒸馏水溶解,在酸式滴定管中加入待测盐酸滴定。
(1)锥形瓶中应加入几滴指示剂,由于CO2溶解在溶液中会影响pH,从准确性考虑,滴定终点宜选在pH为4-5之间,那么指示剂宜选 ,当滴定至溶液由 色变成 色时,即表示到达终点;
(2)若滴定到终点时,消耗盐酸的体积为VmL,则盐酸的物质的量浓度为____ ____mol/L。
Ⅱ。用中和滴定法测定烧碱的纯度,若烧碱中不含有与酸反应的杂质,试根据实验回答:
(1)准确称取烧碱样品5.0g,将样品配成250mL的待测液。
(2)取10.00mL待测液,用 量取注入锥形瓶中。(填仪器)
(3)用0.2000mol/L标准盐酸溶液滴定待测烧碱溶液,滴定时左手 ,
右手 ,两眼注视 ,直到滴定终点。(4)根据下列测定数据,分析得到合理数据,计算待测烧碱溶液的浓度: 。
|
滴定次数 |
待测液体积/mL |
标准盐酸体积/mL |
|
|
滴定前读数(mL) |
滴定后读数(mL) |
||
|
第一次 |
10.00 |
0.50 |
20.40 |
|
第二次 |
10.00 |
4.00 |
24.10 |
|
第三次 |
10.00 |
4.20 |
25.70 |
(5)根据上述测定数据,分析得到合理数据,计算烧碱的纯度 。
17.( 10分)(1)现有pH=2的HCl溶液100 mL,要使它的pH=3,如果加入蒸馏水,需加水 mL;如果加入pH=4的HCl溶液,需加入此HCl溶液 mL(假定溶液体积有加和性,下同)。
(2)将pH=8的NaOH溶液与pH=11的NaOH溶液等体积混合后,溶液的pH= 。(3)将0.1 mol/L盐酸和0.06 mol/L氢氧化钡溶液等体积混合后,该混合溶液pH= 。
(4)25℃时,pH=a的10体积的某强酸与pH=b的1体积的某强碱混合后,溶液呈中性,则a和b 满足的关系 。
16.(12分,方程式2分,其1分)在常温下,下列五种溶液:①0.1mol/L NH4Cl ②0.1mol/L CH3COONH4 ③ 0.1mol/L NH4HSO4 ④0.1mol/L NH3·H2O和0.1mol/L NH4Cl混合⑤0.1mol/L NH3·H2O请根据要求填写下列空白:
(1)溶液①呈 性(填“酸”、“碱”或“中”),其原因是 (用离子方程式表示)
(2)在上述五种溶液中,pH最小的是 ;c(NH4+)最小的是 ﹝填序号﹞,溶液中存在的电离方程式分别为 、
(3)比较溶液②、③中c(NH4+)的大小关系是② ③ ﹝填“>”、“<”或“=”)
(4)在溶液④中, 离子的浓度为0.1mol/L;NH3·H2O和 离子的物质的量浓度之和为0.2 mol/L。
15.(1)(3分)有甲、乙、丙、丁四位同学分别设计了如下实验,证明盐类的水解是吸热的。其中正确的是___________________
甲:将氯化钠溶于水,若水温不变,说明盐类水解是吸热的
乙:在盐酸中加入同浓度的氨水,若反应过程中温度上升,说明盐类水解是吸热的
丙:在醋酸中加入醋酸钠晶体,若溶液温度下降,说明盐类水解是吸热的
丁:在醋酸钠溶液中滴入酚酞试液,加热后红色加深,说明盐类水解是吸热的
(2)(8分)某同学根据所学知识对溶液进行分析,写出了以下四个关系式。请你判断,在正确的关系式后面打“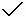 ”,在错误的后面写出正确的关系式。
”,在错误的后面写出正确的关系式。
① c() === 2[c(2-3 )+c(HCO-3 ) ]:
② c()+c(H+) ==c(2-3 )+c(HCO-3 )+c(OH-) :
③ c(OH-) === c(H+)+c(HCO-3 ) +2c():
④ c()>c(2-3 )>c(OH-)>c(HCO-3 ) :
14.MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如下图所示。下列叙述中正确的是 ( )
 A.在x点时,ROH完全电离 B.在x点时,c(R+)= c(M+)
A.在x点时,ROH完全电离 B.在x点时,c(R+)= c(M+)
C.MOH是一种强碱 D.稀释前,c(ROH)=10c(MOH)
13.25 ℃时,在25 mL 0.1 mol·L-1的NaOH溶液中,逐滴加入0.2 mol·L-1的CH3COOH溶液,溶液的pH与醋酸体积关系如图,下列分析正确的是 ( )
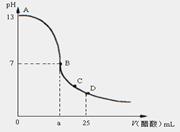 A.B点的横坐标a=12.5
A.B点的横坐标a=12.5
B.C点时溶液中有:c(CH3COO-)> c(Na+) >c(H+)>c(OH-)
C.D点时溶液中有:c(CH3COO-)+c(CH3COOH)=2 c(Na+)
D.曲线上A、B间的任意一点,溶液中都有:
c(CH3COO-)>c(Na+)> c(OH-)> c(H+)
12.用已知浓度的盐酸滴定未知浓度的NaOH溶液会导致测得的NaOH溶液浓度偏高的是 ( )
A.滴定前滴定管中有气泡,滴定后消失 B.碱式滴定管量取NaOH溶液时,未进行润洗
C.摇动锥形瓶时有少量待测液溅出瓶外D.锥形瓶放入NaOH待测液前加少量蒸馏水洗涤
11.下列各组离子一定不能大量共存的是 ( )
A.能使酚酞试液变红的无色溶液中:Na+、CO32-、K+、ClO-、AlO
B.能与金属铝反应放出氢气的溶液中: K+、NO 、Cl-、NH
、Cl-、NH
C.250C时,某溶液中由水电离出的c(OH-)=1×10-13 mol/L:NH4+ 、Fe3+ 、SO42- 、Cl-
D.含有HCO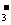 的溶液中:K+、OH-、NO
的溶液中:K+、OH-、NO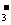 、Ca2+
、Ca2+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com