
有关化学平衡的计算题在高考理综试题中出现的频率很高,然而,无论什么类型的计算题,我们都可以利用“三行式”去分析解决,建立这种思维模式,学生无论遇到怎样复杂的试题时都不至于无从下笔。具体方法为:在可逆反应方程式下面列出到达平衡的过程中,各物质的起始量、转化量和平衡量(其中的“量”为物质的量或浓度,但必须一致),然后根据题中信息找关系,再列方程式计算。
例4.(08年海南)X、Y、Z三种气体,取X和Y按1︰1的物质的量之比混合,放入密闭容器中发生如下反应:X+2Y 2Z ,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3︰2,则Y的转化率最接近于( )
2Z ,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3︰2,则Y的转化率最接近于( )
A.33% B.40% C.50% D.66%
解析:本题考查有关化学平衡的计算。虽然题中没有给出具体数据,但可以引入数据,列出三行式,再找关系列比例式计算。由题意,X和Y物质的量之比为1︰1,不妨假设均为amol,且设X的变化量为x mol,则可建立以下三行式:
X + 2Y 2Z
2Z
起始量(mol): a a 0
变化量(mol): x 2x 2x
平衡量(mol):(a-x) (a-2x) 2x
= ∴x=
则Y的转化率为 a÷×100%≈67%,答案为D。
对于化学平衡移动问题的分析可建立以下思维模式:

条件改变 平衡移动 各种量变
由外界条件的改变结合反应的特点(正反应为吸热还是放热反应、正反应是气体体积增大还是缩小的反应)可以判断平衡移动的方向,平衡移动必然导致各种量变;反过来,由题目告知的量变信息,可以反过来判断平衡移动的方向,再由平衡移动的方向结合反应特点(或条件的改变)可以判断条件的改变(或反应特点)。那么,在具体解题时,我们所要做的是由题中信息分析“条件的改变”、“反应的特点”、“各种量变”等内容,然后根据它们的联系作答。
例2.(09年四川)在一体积可变的密闭容器中,加入一定量的X、Y,发生反应
mX(g) nY(g) △H= QkJ·mol-1。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示:
nY(g) △H= QkJ·mol-1。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示:
 气体体积
气体体积 c(Y) c(Y)温度 |
1 |
2 |
3 |
|
100℃ |
1.00 mol·L-1 |
0.75 mol·L-1 |
0.53 mol·L-1 |
|
200℃ |
1.20 mol·L-1 |
0.09 mol·L-1 |
0.63 mol·L-1 |
|
300℃ |
1.30 mol·L-1 |
1.00 mol·L-1 |
0.70 mol·L-1 |
下列说法正确的是( )
A.m>n
B.Q<0
C.温度不变,压强增大,Y的质量分数减少
D.体积不变,温度升高,平衡向逆反应方向移动
解析:本题根据表格数据考查化学平衡移动问题。由表中数据可得出条件改变和各种量变间的关系,从而可以分析得出该反应的特点。根据表中数据,若温度恒定为100℃,当气体体积由1变为2时,c(Y) 由1.00mol·L-1变为0.75mol·L-1,根据过程假设的思想,把这个过程假设为两个阶段,第一个阶段为气体体积由1变为2,但平衡未移动,则压强变为原来的一半,c(Y)变为0.50mol·L-1,第二个过程为压强变为原来的一半后,平衡发生移动,使c(Y)由0.50mol·L-1变为0.75mol·L-1,则可以看出减压使c(Y)增大,平衡正向移动,所以正反应为气体体积增大的反应,∴m<n,A选项错;若气体体积为1不变时,从表中数据可看出,升温使c(Y)增大,即升温使平衡正向移动,说明正反应为吸热反应,∴Q>0,B、D选项均错;压强增大,平衡逆向移动,则Y的质量分数减少,C选项对,答案为C。
例3.(09年全国II,有删减)某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如下表所示。

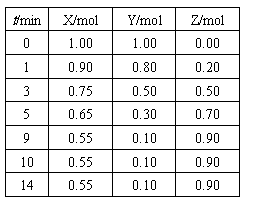
(1)体系中发生反应的化学方程式是 。
(2)如果该反应是放热反应。改变实验条件(温度、压强、催化剂)得到Z随时间变化的曲线①、②、③(如右图所示)则曲线①、②、③所对应的实验条件改变分别是:① ,② ,③ 。
解析:(1)由参加反应的各物质的物质的量之比等于其化学计量数之比不难得出该反应的方程式为:X+2Y 2Z;(2)本小题通过图像考查平衡移动问题,从图像中我们可以分析得出各种量变情况,再结合反应特点可反推出条件的改变。由表格可看出,改变条件前,反应在第9min时达平衡,平衡时Z的物质的量为0.9mol,改变实验条件后,曲线①、②、③达平衡所需时间均缩短(小于9min),即反应速率均加快,则外界条件的改变为升高温度、增大压强或加入催化剂,其中①平衡时Z的物质的量减小为0.6mol,说明平衡逆向移动,结合正反应为放热反应,可知条件改变为升高温度;②平衡时Z的物质的量仍为0.9mol,说明平衡状态未改变,则为加入催化剂;③平衡时Z的物质的量增大为0.95mol,说明平衡正向移动,结合正反应为气体体积缩小的反应,可知条件改变为增大压强。
2Z;(2)本小题通过图像考查平衡移动问题,从图像中我们可以分析得出各种量变情况,再结合反应特点可反推出条件的改变。由表格可看出,改变条件前,反应在第9min时达平衡,平衡时Z的物质的量为0.9mol,改变实验条件后,曲线①、②、③达平衡所需时间均缩短(小于9min),即反应速率均加快,则外界条件的改变为升高温度、增大压强或加入催化剂,其中①平衡时Z的物质的量减小为0.6mol,说明平衡逆向移动,结合正反应为放热反应,可知条件改变为升高温度;②平衡时Z的物质的量仍为0.9mol,说明平衡状态未改变,则为加入催化剂;③平衡时Z的物质的量增大为0.95mol,说明平衡正向移动,结合正反应为气体体积缩小的反应,可知条件改变为增大压强。
答案:(1)X+2Y 2Z (2)升高温度
加入催化剂 增大压强
2Z (2)升高温度
加入催化剂 增大压强
可逆反应达到化学平衡状态后,反应混合物中各组分的浓度保持不变,实际上,不仅各组分的浓度,其他物理量也均保持不变。然而,当外界条件改变时,平衡将被破坏并发生移动,平衡移动则导致一些物理量发生变化。我们可以建立这样的思维模式去判断可逆反应是否达到平衡:若平衡移动必然导致某物理量发生改变,则一旦反应混合物中该物理量不再改变,说明可逆反应已达平衡。如,对于合成氨反应,恒温恒容时,平衡移动必然使总压改变,则当总压不变时,说明反应已达平衡;而对于反应H2(g)+I2(g)  2HI(g),恒温恒容时,平衡移动总压不变,则不能根据总压来判断反应已达平衡。
2HI(g),恒温恒容时,平衡移动总压不变,则不能根据总压来判断反应已达平衡。
例1.(08年江苏,有删减)将一定量的SO2和含0.7 mol氧气的空气(忽略CO2)放入一定体积的密闭容器中,550 ℃时,在催化剂作用下发生反应:2SO2+O2 2SO3(正反应放热)。判断该反应达到平衡状态的标志是
。(填字母)
2SO3(正反应放热)。判断该反应达到平衡状态的标志是
。(填字母)
a.SO2和SO3浓度相等 b.SO2百分含量保持不变
c.容器中气体的压强不变 d.SO3的生成速率与SO2的消耗速率相等
e.容器中混合气体的密度保持不变
解析:SO2和SO3浓度相等仅仅是反应过程中某一瞬时的关系,a错;若平衡正向(或逆向)移动,必然导致SO2百分含量减小(或增大),容器中气体的压强减小(或增大),而容器中混合气体的密度不变,则b、c对,e错;d中“SO3的生成速率”与“SO2的消耗速率”均为正反应速率,错。答案:bc。
6、评讲:复习中,针对需要点评的问题,结合精讲、精练、讲练结合,给学生介绍规律性的知识以及巧解、妙解、快速解题的方法,使学生收到事半功倍的效果。有时两三道题所涉及的内容、知识点、规律,结合学生在复习中存在的问题就分析、讲解一节课。针对学生掌握知识的程度,边点边评,随点随评,发现问题,及时解决,从而使学生的问题越来越少,知识积累得越来越多,能力就会越来越强。
第二轮复习在第二学期进行,分基本概念、基本理论,元素及化合物、有机物、实验几大块,可依据实际情况灵活安排。
第三轮复习五月份进行大综合训练,做好各地信息题及理综卷题型专题训练。
5、精练:教师要精心选编适量的不同类型练习题进行精练。切忌搞“题海战术”,习题离课本的距离太远。所选习题必须是不离开课本的基础知识所涉及的内容,在复习中发现,有的学生练了大量的综合题,但一遇到课本上习题和问题还是照样出现错误。练习要针对不同的阶段、不同的问题和不同的复习内容,采取不同的练习方式达到精练的目的。
4、精讲:由于总复习阶段时间紧,任务重,因此,教师无论是在讲复习课,还是在回答学生提出的问题,都要做到有目标地精讲。学生一看就明白的问题,教师不宜在课堂上讲来讲去,而是要给学生讲方法、讲原理、讲技巧、讲关键、讲思路、讲规律,起到举一反三、画龙点睛的功效。
3、讨论:在前两环节的基础上,组织学生对思考题在存在的疑点、难点进行讨论。通过分析、讨论使学生搞清自己的遗留问题,加深印象,从而使每个思考题涉及的同一类问题清楚,做到“万变不离其宗”。抓住分析讨论这一环节,学生就会获得牢固的知识。
通过对知识点、高考试题及学生学习中存在的主要问题的分析、观察,目前化学学科的教学中存在的问题一是:一听就懂、一看就会,一做就错、一考就糟。为此,在教学中采取的措施是:认真听讲、反复联想、熟能生巧、能力渐长。二是概念多,理论多,实验杂,计算难,题型活。反应多,容易忘:前面学,后面忘:容易学、容易忘。在教学、复习中采取的措施是:正确理解、注意联想,重视实验,讲究巧练,培养能力,善于记忆,前后对比,摸索规律,经常回忆,不易忘记。例如:在复习一定物质的量浓度的配制时我们采取一副对联:一算二量三溶四冷五转移,六洗七加八定九摇十装贴。既增强了记忆又加深了理解。对硫酸工业通过“三三两两”四个字概括了硫酸工业的原理、阶段、设备。学生复习起来轻松、透彻。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com