
针对所学知识中重点、难点、疑点问题,可进行专题化训练,要练到火候:练速度、练准确率、练答题技巧,练语言表达能力,练分析问题的能力,特别是在有限的时间内,让学生具有实战能力。
高三复习,做题避免不了,但易陷入题海中,整天做题、讲题,然后再做,学生没有理解深化的过程,很难把知识掌握到位。物理学家卢瑟福带弟子,问之:上午干什么?答:实验室;又问之:下午干什么?答:实验室;复又问之:晚上干什么?答:实验室;卢瑟福追问了一句:你整天都在做实验,那你什么时间进行思考呢?没有思考,也就不可能有深化的过程,更谈不上提高。为了达到精讲,教师必须要钻研大纲,熟悉教材,把握知识的重难点,删去偏、难、怪题。让学生把精力都放在基础知识的掌握上,能力的提高上。教师在组题时,可挑选一些比较好的试题,但尽量不要用成题,原题,及使用,也要在原有基础上加以变动,要有创意,内容上要尽量涵盖所有的知识点,一则使学生不会感到枯燥,二则也提高了教师对知识的把握精度,编题的水平,虽然教师要付出相当大的工作量,可会节省下学生的更多宝贵时间,同时,大大地提高了复习的效率。这样也就避免了各学科间相互抢课,挤占时间的现象的出现。
学期初,任课教师通过集体商讨,制定出本学科的复习计划,并选定好一本复习资料;然后据本学科的学科特点和内容,确定好每位教师应具体负责的内容,章节内容要落实到人,目的、要求要具体明确。所有计划做出后,印发到各班,分发到学生手中,使学生做到心中有数。
2、由于,高中教材中不再涉及化学平衡常数的概念,所以,不好从浓度商和平衡常数的角度给出平衡移动的判断标准,但从化学反应速率的角度给出平衡移动的标准学生是可以接受的。笔者建议,新的教材中不妨从化学反应速率角度明确给出平衡移动的标准。
在恒温恒容下,对于反应:2NO2=N2O4 ,若增加N2O4的浓度时,浓度和压强都增大,最终平衡究竟往哪个方向移动,NO2的转化率该如何变化.遇到此类问题,应以物理变化(加入物质,浓度增大)的影响为主(主要矛盾),化学变化(即平衡移动)为辅(次要矛盾)。
平衡转移看浓度转化率看压强我们老师是这么教的~那此题NO2的转化率应该变大吧
3.反应向右进行,平衡向左移动。理由:增大反应物的浓度,正反应速率增大,此时逆反应速率不变,所以,反应向正反应方向进行。由于,新加入的PCl5的转化率比原来容器中的低(原理分析同1),所以,平衡向左移动了。
下面说明一下,以上观点的错误原因:
观点一:把平衡后再充入1mol PCl5的过程,同开始就充入2 mol PCl5等价,本身犯了“偷换概念”的错误。即使等价于开始充入2 mol PCl5,也不能称之为平衡的移动,平衡的移动是指对于同一容器中的达到平衡的可逆反应,因条件改变而引起的变化。
观点二:不能把平衡移动的方向和物质的百分含量联系在一起。如:在一定温度下,某密闭容器中进行合成氨的反应N2+3H2 2NH3达到平衡,再充入n
mol H2平衡向右移动,达新平衡后NH3的百分含量增大吗?很明显,不一定,这取决于n与原来平衡混合气的总物质的量的大小对比(主要)和反应进行的程度;如:n远大于原平衡混合气的总物质的量时,氨气的百分含量一定减小了。所以,化学平衡移动的方向与物质的百分含量无关。
2NH3达到平衡,再充入n
mol H2平衡向右移动,达新平衡后NH3的百分含量增大吗?很明显,不一定,这取决于n与原来平衡混合气的总物质的量的大小对比(主要)和反应进行的程度;如:n远大于原平衡混合气的总物质的量时,氨气的百分含量一定减小了。所以,化学平衡移动的方向与物质的百分含量无关。
观点三:好象很圆滑,但也犯了将平衡移动方向和反应物的转化率混为一谈的错误。认为转化率提高平衡就向右移动,反之向左移动,本身就是错误的。举例说明:一定温度下,在一体积固定的密闭容器中,加入1 mol H2和1 mol I2(g),达到平衡后,充入1 mol H2则平衡向右移动,再充入1 mol I2(g)平衡又向右移动,但根据转化率的关系,因为首次平衡和最终平衡态的转化率相等,就会得出两次右移等于平衡不移动的谬论。
产生以上错误的根本原因在于没有弄清楚,平衡移动的判断标准,化学平衡的移动是旧的平衡被破坏,建立新平衡的过程,旧的平衡被破坏的原因是v(正)=v(逆)的条件被打破,从而产生两种平衡移动的方向,v(正)′> v(逆)′平衡右移,v(正)′< v(逆)′平衡左移。
综上所述,化学平衡移动的标准是:改变外界条件后v(正)′和v(逆)′的大小关系,若v(正)′> v(逆)′则平衡右移,若v(正)′< v(逆)′则平衡左移,或者说是和反应进行的方向一致。
对教材的建议:


 1、大学教材中,化学平衡移动的判断依据是:反应商(Q)与标准平衡常数( )的相对大小的变化,平衡时Q= ,改变条件使Q< ,平衡被破坏,反应向正向(或逆向)进行,之后重新建立平衡,我们说平衡右移(左移)
1、大学教材中,化学平衡移动的判断依据是:反应商(Q)与标准平衡常数( )的相对大小的变化,平衡时Q= ,改变条件使Q< ,平衡被破坏,反应向正向(或逆向)进行,之后重新建立平衡,我们说平衡右移(左移)
1.平衡向左移动了。理由:再向容器中加入1 mol PCl5,和开始加入2 mol PCl5达到平衡时的效果一样。容积固定的密闭容器中,成比例的增大反应物的量,相当于加压过程(图示中乙容器充了2 mol PCl5,等价于丙容器充入2 mol PCl5达到平衡后,将活塞从B推至A处),所以加压平衡向左进行。
 2.平衡向左移动。理由:达到新平衡时,加入的PCl5未转化的更多了,容器中PCl5的百分含量比原来容器中的高(原理分析同1),所以,平衡向左移动了。
2.平衡向左移动。理由:达到新平衡时,加入的PCl5未转化的更多了,容器中PCl5的百分含量比原来容器中的高(原理分析同1),所以,平衡向左移动了。
4、重视有机计算复习
(1)燃烧规律的应用
有机物完全燃烧化学方程式为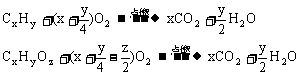
①最简式相同的有机物, 以任意比例混合,总质量一定时, 生成的CO2是一定值, 生成水的量也是定值, 消耗氧的量也是定值。
②混合物总质量不变, 以任意比例混合时, 生成CO2相等, 即含碳量相等(质量分数),
生成H2O相等, 即含氢量相等(质量分数)。
③具有相同碳原子数的有机物, 无论以任意比例混合, 只要总物质的量一定, 生成的
CO2为一定值。
④最简式相同, 无论有多少种有机物, 也无论以何种比例混合, 混合物中元素质量比为定值。
(2)记忆常见烃及烃的衍生物的内在联系
①常见最简式相同的物质:互为同分异构体的有机物有:乙炔和苯、甲醛和乙酸、葡萄糖等。
②某些具有相同相对分子质量有机物有:




6、聚合反应:
包括:加聚反应(也可认为是加成反应的拓宽)和缩聚反应。由高聚物链节判断单体结构。主要根据加聚反应和缩聚反应的原理进行。加聚反应是通过不饱和单体聚合而得,有乙烯类、混和烯类及其不饱和单体加聚类;缩聚反应是由两种或两种以上单体合成高分子化合物时有小分子生成(H2O或HX等)的反应,基本的缩聚反应有:二元醇与二元酸之间的缩聚、氨基酸(苯酚与HCHO的缩聚)之间的缩聚等。
(3)六类有机物的通式
根据各类烃及含氧衍生物应熟练掌握CnH2n+2、CnH2n、CnH2n-2、CnH2n+2O、CnH2nO、CnH2nO2等通式,并能具体分析n的取值,通式的含义,碳、氢或碳、氢、氧的质量关系,且能变形为其它形式,找出一些内在的关系。如某醛为CnH2nO时,则与它相对分子质量相同的物质有Cn+1H2(n+1)+2(即Cn+1H2n+4),原因是,当烷烃变形为CnH2n·CH4时,与上述醛相比式量中CnH2n部分相同,则余下部分1个O原子式量与1个CH4式量相等。在通式应用中就要能够对比、变通。
5、氧化反应:
包括:燃烧氧化和去氢加氧的催化氧化
4、裂化、裂解反应
裂化举例:C16H34→C8H18+C8H16 C8H18→C4H10+C4H8
裂解是深度裂化:如:C4H10→C2H6+C2H4 C4H10→CH4+C3H6
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com