
12、(17分)向一体积不变的密闭容器中加入2mol A、0.6molC和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如图一所示。图二为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。已知t3-t4阶段为使用催化剂, t5-t6 阶段为升高温度,图一中t0-t1阶段c(B)未画出。
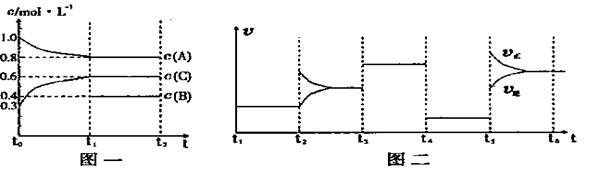
(1)若t1=15min,则t0-t1阶段以C浓度变化表示的反应速率为v(C)= 。
(2)t4-t5阶段改变的条件为 ,B的起始物质的量为 。
(3)此反应的化学方程式可表示为 ,该反应为
(填“放”或“吸”)热反应。
(4)各阶段平衡时对应的平衡常数如下表所示:
|
t1-t2 |
t2-t3 |
t3-t4 |
t4-t5 |
t5-t6 |
|
K1 |
K2 |
K3 |
K4 |
K5 |
则K1= (保留两位小数),K1、K2、K3、K4、K5之间的关系为 (用“>”、“<”或“=”连接)
11、(15分)恒温下,将amolN2与bmolH2的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2(g)+3H2(g)  2NH3(g)
2NH3(g)
(1)若反应进行到某时刻t时,nt(N2)=13mol,nt(NH3)=6mol,则a的值为 。
(2)反应达平衡时,混合气体的体积为716.8L(标准状况下),其中NH3的含量(体积分数)为25%。则平衡时NH3的物质的量为 。
(3)平衡混合气体中,n(N2):n(H2):n(NH3)= 。
(4)原混合气体中,a:b= 。
(5)原混合气体与平衡混合气体的总物质的量之比(写最简整数比,下同),n(始):n(平)= 。 (6)达到平衡时,N2和H2的转化率之比,a(N2):a(H2)= 。
10、(18分)某强酸性反应体系中,反应物和生成物共六种物质:O2 、MnO4-、H2O 、Mn2+ 、H2O2 、H+ 。已知该反应中H2O2 只发生了如下过程:H2O2 →O2。
(1)该反应应选择的酸是: (填序号)。
A.盐酸 B.浓硫酸 C.稀硫酸 D.醋酸。
(2)该反应中发生还原反应的过程是: → 。
(3)写出该反应配平的离子方程式并标出电子转移的方向和数目:
(4)如果上述反应中有6.72L(标准状况.)气体生成,转移的电子数为 mol。
(5)H2O2有时可作为矿业废液消毒剂,如消除采矿业胶液中的氰化物(如KCN),经以下反应实现:KCN + H2O2+H2O ==== A + NH3↑,试指出生成物A的化学式为 。
(6) H2O2还有“绿色氧化剂”的美称,阐明H2O2被称为绿色氧化剂的理由是 。
9、(14分)设反应①Fe(s)+CO2(g) ) FeO(s)+CO(g);△H=Q1的平衡常数为K1,反应②Fe(s)+H2O(g)
FeO(s)+CO(g);△H=Q1的平衡常数为K1,反应②Fe(s)+H2O(g)
 FeO(s)+H2(g);△H=Q2的平衡常数为K2,在不同温度下,K1、K2的值如下:
FeO(s)+H2(g);△H=Q2的平衡常数为K2,在不同温度下,K1、K2的值如下:
|
T/K |
K1 |
K2 |
|
973 |
1.47 |
2.38 |
|
1 173 |
2.15 |
1.67 |
(1)从上表可推断,反应①是 (填“放”或“吸”)热反应。
(2)现有反应③H2(g)+CO2(g) CO(g)+H2O(g);△H=Q3平衡常数为K3。
CO(g)+H2O(g);△H=Q3平衡常数为K3。
根据反应①与②推导出K1、K2、K3的关系式K3= ;
可推断反应③是 (填“放”或“吸”)热反应。要使反应③在一定条件下建立的平衡右
移,可采取的措施有 。
A.缩小容器体积 B.降低温度 C.使用合适的催化剂
D.设法减少CO的量 E.升高温度
(3)根据反应①与②推导出Q1、Q2、Q3的关系式Q3= 。
8、对于平衡体系mA(g)+nB(g)==pC(g)+qD(g);△H<0,下列结论不正确的是( )
A.若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来2倍,则m+n>p+q
B.若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m∶n
C.若m+n=p+q,则往含有a mol 气体的平衡体系中再加入a mol的B,达到新平衡时,气体的总物质的量等于2a
D.若温度不变,压强增大到原来的2倍,达到平衡时,总体积一定比原来的1/2要小
7、下列物质能跟镁反应并生成氢气的是 ( )
A.甲酸溶液 B.氢氧化钠溶液 C.氯化铵溶液 D.碳酸钠溶液
6、将20mL0.4mol·L-1硝酸铵溶液跟50mL0.1mol·L-1氢氧化钡溶液混合,则混合溶液中各离子浓度的大小顺序是 ( )
A.c(NO3- )>c(OH一 )>c(NH4+)>c(Ba2+) B.c(NO3- )>c(Ba2+)>c(OH一)> c(NH4+)
C.c(Ba2+)>c( NO3-)>c(OH一)>c( NH4+) D.c( NO3-)> c(Ba2+)> c(NH4+)> c(OH一)
5、 一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )
一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )
A.反应的化学方程式为:2M==N
B.t2时,正逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D. t1时,N的浓度是M浓度的2倍
4、用反应:2NO(g)+2CO(g) 2CO2(g)+N2(g) △H=-746.8kJ·mol-1,可净化汽车尾气,如果要同时提高该反应的速率和NO的转化率,采取的措施是( )
2CO2(g)+N2(g) △H=-746.8kJ·mol-1,可净化汽车尾气,如果要同时提高该反应的速率和NO的转化率,采取的措施是( )
A.降低温度 B.增大压强同时加催化剂
C.升高温度同时充入N2 D.及时将CO2和N2从反应体系中移走
3、关于盐酸与醋酸两种稀溶液的说法正确的是( )
A.相同物质的量浓度的两溶液中c(H+)相同
B.pH=3的两溶液稀释100倍,pH都为5
C.100 mL 0.1 mol/L的两溶液能中和等物质的量的氢氧化钠
D.两溶液中分别加入少量对应的钠盐,c(H+)均明显减小
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com