
18.(10分)红矾钠(重铬酸钠:Na2Cr2O7·2H2O)是重要的基本化工原料,在印染工业、电镀工业和皮革工业中作助剂,在化学工业和制药工业中也用作氧化剂,应用领域十分广泛。
(1) 实验室中红矾钠可用铬铁矿(主要成分:FeO·Cr2O3)利用以下过程来制取。
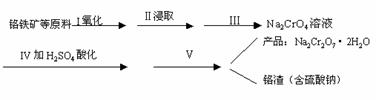
①步骤I中反应的化学方程式为:
4FeO·Cr2O3(s)+8Na2CO3(s)+7O2
 8Na2CrO4(s)+2Fe2O3(s)+8CO2;△H<0
8Na2CrO4(s)+2Fe2O3(s)+8CO2;△H<0
该反应的化学平衡常数的表达式为 。
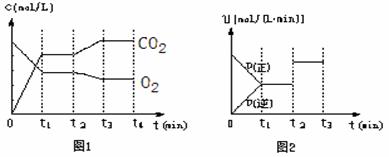
②图1、图2表示该反应在t1时达到平衡、在t2时因改变某个条件而发生变化的曲线:
由图1判断,反应进行至t2 min时,曲线发生变化的原因是 (用文字表达)。由图2判断,t2 min到t3 min 的曲线变化的原因可能是 ____ (填编号)
a.升高温度 b.加了催化剂 c.将原料粉碎 d.缩小容器体积
(2)步骤Ⅱ中所得溶液显碱性,其中除含有Na2CrO4外还含有铝、硅元素的化合物,它们的化学式可能是 、 。
①步骤Ⅲ需将溶液的pH调至7~8并煮沸,其目的是 。
②步骤Ⅳ中发生反应的离子方程式为: 。
17.(10分)现有A、B、C、D、E五种强电解质,它们在水中可电离产生下列离子(各种离子不重复)。
|
阳离子 |
H+、Na+、A13+、Ag+、Ba2+ |
|
阴离子 |
OH-、C1-、CO32-、NO3-、SO4- |
已知:①A、B两溶液呈碱性;C、D、E溶液呈酸性。
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生(沉淀包括微溶物,下同)。
③D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀。
试回答下列问题:
(1)将C溶液逐滴加入等体积、等物质的量的浓度的A溶液中,反应后溶液中各种离子浓度由大到小的顺序为:
 。
。
(2)写出E溶液与过量的B溶液反应的离子方程式。
。
(3)已知:NaOH(aq)+HNO3(aq)=NaNO3(aq)+H2O(1);
△H=-a KJ·mol-1。请写出B与C的稀溶液反应的热化学方程式
。
(4)在100mL0.1mol·L-1E溶液中,逐滴加入35mL 2mol·L-1NaOH溶液,最终得到沉淀物 质的量为
。
质的量为
。
16.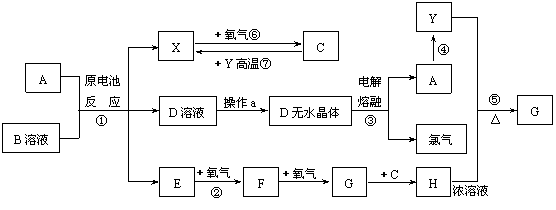 (8分)已知A为常见金属,X、Y为常见非金属,X、E、F、G常温下为气体,C为液体,B是一种盐,受热极易分解,在工农业生产中用途较广(如被用作某些电池的电解质)。现用A与石墨作电极,B的浓溶液作电解质,构成原电池。有关物质之间的转化关系如下图:(注意:其中有些反应的条件及部分生成物被略去)
(8分)已知A为常见金属,X、Y为常见非金属,X、E、F、G常温下为气体,C为液体,B是一种盐,受热极易分解,在工农业生产中用途较广(如被用作某些电池的电解质)。现用A与石墨作电极,B的浓溶液作电解质,构成原电池。有关物质之间的转化关系如下图:(注意:其中有些反应的条件及部分生成物被略去)
请填写下列空白:
(1)反应④为A在某种气体中燃烧,生成单质Y和A的氧化物,其反应方程式为
 。(2)从D溶液制备D的无水晶体的“操作a”为
。
。(2)从D溶液制备D的无水晶体的“操作a”为
。
(3)反应②的化学方程式为 。
(4)反应⑤的化学方程式为 。
15、(10分) 碱式氯化铜(Cupric Chloride,不溶于水的绿色结晶)是一种农药,分子式:CuCl2·3Cu(OH)2·XH2O(X=1/2,1,2)。为验证其组成并确定X值,某学生设计了以下几步实验:① 取a g的晶体研成粉末。② 晶体在空气中加热至确认质量不再变化为止(铜仍为二价),冷却后称其质量为b g。③ 另取a g的晶体,溶于足量某溶液中充分溶解得到溶液。④ 向③得到的溶液中加入足量的硝酸银溶液,最后得到纯净固体称量为c g。
若以上操作均正确,试回答下列问题:
(1)以上实验中用到玻璃棒的步骤有 ____ (填序号)。
(2)步骤②中晶体应放在______ __(填仪器名称)中灼烧,灼烧后得到的固体应为___________(填化学式)。
(3)步骤③所用的溶液可能是 ;
(4)步骤④主要包括:加入足量硝酸银溶液→ → → 晾干→称量;
(5)若组成符合通式,则可以计算X的物理量组合是 ____ (填序号)。
A.a、b B.a、c C.b、c D.a、b、c缺一不可
14、a g下列物质在氧气中充分燃烧后的气体(1.01×1 05 Pa,120℃),通过足量的过氧化钠充分反应后,过氧化钠增重b g,符合b>a 的选项有
05 Pa,120℃),通过足量的过氧化钠充分反应后,过氧化钠增重b g,符合b>a 的选项有
A.HCHO B.CH3COOCH2CH3 C.HOOCCOOH D.纤维素
第二卷(非选择题 共72分)
13.将某些化学知识用数轴表示直观形象、简明易记。下列用数轴 表示正确的是
表示正确的是
A.平衡常数与转化率关系: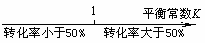
B.分散系的分类: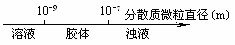

 C.AlCl3和NaOH反应后铝元素的存在形式:
C.AlCl3和NaOH反应后铝元素的存在形式: D.Na在O2中的燃烧产物:
D.Na在O2中的燃烧产物: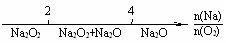
12、已知某弱酸的酸式盐有NaH2XO4和Na2HXO4,其中NaH2XO4的溶液呈酸性,Na2HXO4溶液呈碱性。30℃时,浓度均为0.1mol•L-1NaH2XO4溶液和Na2HXO4溶液中均存在的关系是
A.c(H+)•c(OH-) >1×10-14
B.c(H+) + 2c(H3XO4)+ c(H2XO4-)=c(XO43-)+ c(OH-)
C. c(Na+)+ c(H+)= c(H2XO4-)+ c(OH-)+ 2c(HXO42-)+ 3c(XO43-)
D.c(H+) + c(H3XO4)= c(HXO42-)+ 2c(XO43-)+ c(OH-)
11.“人文奥运、科技奥运、绿色奥运”是2008年北京奥运会的重要特征。其中禁止运动员使用兴奋剂是重要举措之一。以下两种兴奋剂的结构分别为:
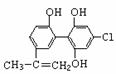

①利尿酸 ②兴奋剂X
则关于它们的说法中正确的是
A.利尿酸分子中有三种含氧官能团,在核磁共振氢谱上共有六个峰
B.1 mol兴奋剂X与足量浓溴水反应,最多消耗4 mol Br2
C.两种兴奋剂均属于芳香烃化合物
D.两种分子中的所有碳原子均不可能共平面
10、下列离子方程式不正确的是
A.Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O
B.4mol·L-1的NaAlO2溶液和7mol·L-1的HCl等体积互相均匀混合
4AlO2-+ 7H+ + H2O = 3Al(OH)3↓+ Al3+
C.在含有Mn2+的溶液中加入HNO3再加入PbO2,则反应体系显紫红色
5PbO2 + 2Mn2+ + 4H+ = 5Pb2+ + 2MnO4- + 2H2O
D.甲醛溶液中加入足量的银氨溶液并加热
HCHO+2[Ag (NH3)2]++2OH- HCOO-+NH4++2Ag↓+3NH3+H2O
HCOO-+NH4++2Ag↓+3NH3+H2O
9、高铁酸钾K2FeO4是一种新型、高效、氧化性比Cl2更强的水处理剂,工业上通常用下列反应先制得高铁酸钠:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,然后在某低温下,在高铁酸钠溶液中加KOH固体至饱和就可析出高铁酸钾,下列有关说法不正确的是
A. Na2O2在反应中既作氧化剂,又作还原剂
 B. 制取高铁酸钠时,每生成lmolNa2FeO4反应中共有4mol电子转移
B. 制取高铁酸钠时,每生成lmolNa2FeO4反应中共有4mol电子转移
C.高铁酸钾在该温度下的溶解度比高铁酸钠的溶解度小
D. K2FeO4能消毒杀菌,其还原产物水解生成的Fe(OH)3胶体能吸附水中的悬浮杂质
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com